2. TINCIÓN DE GRAM
2.1 Método
2.1.1 Extensión: En un porta bien limpio (con alcohol, papel de filtro y flameado) se coloca una gota de agua destilada a la que. con el asa de
siembra, previamente esterilizada a la llama, se lleva una pequeña cantidad de suspensión de bacterias
o, en su caso, de una colonia.
Con el asa se extiende la gota y las bacterias sobre el porta y se fija la extensión por el
calor, calentando suavemente a la llama del mechero hasta que se seque.
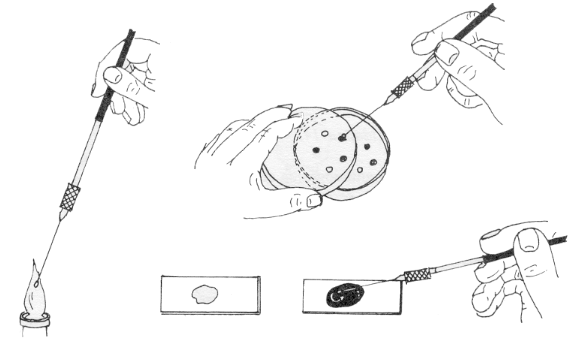
2.1.2 Coloración:
a) 1 minuto en cristal violeta de Hucker (colorante inicial)
b) se lava con agua destilada
c) 1 minuto en lugol (mordiente)
d) se decolora con alcohol de 95° (decolorante)
e) se lava con agua destilada
f) 1 minuto en safranina (colorante de contraste)
g) se lava con agua corriente
h) se seca suavemente y sin frotar con papel de filtro
Una vez que la preparación está totalmente seca, poner una gota muy pequeña de aceite de cedro y observar al microscopio con el objetivo de inmersión.
2.2. Observación
 Debe utilizarse el objetivo de inmersión.
Debe utilizarse el objetivo de inmersión.
Se coloca una gota de aceite de cedro sobre la preparación. Se enfoca, preferentemente, con el
micrométrico.
Después de utilizar el objetivo de inmersión debe limpiarse con xilol
Observaciones realizadas: anótalas en tu cuaderno ¿Qué forma tienen las bacterias observadas? ¿Las bacterias aparecen aisladas o agrupadas? En caso de que aparezcan agrupadas indicar el tipo de asociación. Indica tipo de Gram.