5.- Constitución del átomo
Actividad de Lectura
 |
| Imagen de dominio público. Estadio centenario. |
¿Te has hecho una buena idea del átomo?, ¿también de su tamaño?.
El átomo es muy, muy, pero que muy pequeño, su tamaño es del orden de 10-10 m, es decir: 0,0000000001 m. ¿Te haces una idea de lo pequeñito que es?. Si tomáramos 10 millones de átomos y los colocáramos juntos, uno al lado de otro, formaríamos una cadena que mediría, más o menos, un centímetro.
Pero además el núcleo es aún más pequeño, su tamaño es 10 000 veces más pequeño que el del átomo, así que imaginate... Si el átomo tuviera el tamaño de un campo de fútbol, el núcleo tendría el tamaño de un garbanzo y los electrones serían como pequeñas motas de polvo agitadas por el viento entre los asientos.
Si necesitas ayuda para hacerte una idea de las dimensiones del átomo, pulsa en el botón que hay a continuación y verás una animación en la que podrás acercarte hasta un átomo de carbono, haciendo zoom con la barra inferior.
Actividad
Las partículas fundamentales son el electrón, el protón y el neutrón, ya que son necesarias y suficientes para construir un modelo atómico aceptable y satisfactorio.
| Electrón |
|
| Protón |
|
| Neutrón |
|
Pregunta de Elección Múltiple
- Número atómico Z: Es el número de protones (y de electrones) que posee el átomo neutro.
- Número de Neutrones N: Es el número de neutrones que posee el átomo.
- Número másico A: Es el número de partículas pesadas que el átomo posee, es decir,el número de protones y de neutrones ( A = Z + N).
Actividad
La notación utilizada para representar los átomos es la siguiente:
![]() que puede simplificarse a la forma:
que puede simplificarse a la forma: ![]()
- X: símbolo del elemento químico.
- Z: número atómico.
- A: número másico.
Por ejemplo los siguientes átomos:
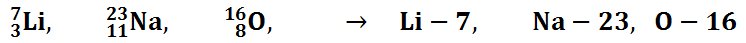
se corresponden, respectivametne con los átomos de litio(3 protones, 4 neutrones, 3 electrones), sodio (11 protones, 12 neutrones, 11 electrones) y oxígeno (8 protones, 8 neutrones y 8 electrones).
Los átomos de un elemento se caracterizan por el número de protones que tengan, independientemente del número de otras partículas que posean. Por eso tienes que comprender muy bien lo siguiente:
-
Si el número de electrones es distinto del de protones, entonces resulta una carga neta en el átomo, es decir, tenemos un ión (monoatómico). Esto puede conseguirlo el átomo por ganar o perder electrones.
- Si un átomo gana electrones, tendrá menos protones que electrones, resultando una carga negativa, es decir tendremos un ión negativo, cuya carga coincidirá con el número de electrones ganados.
Por ejemplo, el ión: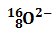 está constituido por 8 protones, 8 neutrones y 10 electrones.
está constituido por 8 protones, 8 neutrones y 10 electrones. - Si un átomo pierde electrones, resultará que el número de protones será mayor que el de electrones, resultando una carga positiva igual a número de electrones perdidos.
Por ejemplo, el ión: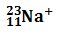 está constuido por 11 protones, 12 neutrones y 10 electrones.
está constuido por 11 protones, 12 neutrones y 10 electrones.
- Si un átomo gana electrones, tendrá menos protones que electrones, resultando una carga negativa, es decir tendremos un ión negativo, cuya carga coincidirá con el número de electrones ganados.
-
Cuando tenemos átomos que aunque poseen igual número de protones difieren en el número de neutrones, se dice que son isótopos.Todos los isótopos de un elemento tienen idénticas propiedades químicas y solamente difieren en las propiedades físicas que dependen de la masa, por ello se consideran un mismo elemento químico.
Por ejemplo, los siguientes átomos son isótopos: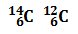 los dos tienen 6 protones y 6 electrones, pero el primero tiene 8 neutrones y el segundo sólo tiene 6 neutrones.
los dos tienen 6 protones y 6 electrones, pero el primero tiene 8 neutrones y el segundo sólo tiene 6 neutrones.