4.- Modelo atómico de Bohr
Pre-conocimiento
 |
| Imagen de dominio público. Niels Bohr. |
¿Sabías que el profesor Niels Bohr era un amante de las "pelís" del Oeste?. Le encantaba ir a ver los "Western" con su alumnos y luego continuar con interminables charlas sobre las complicadas tramas que involucraban a indios hostiles, valientes cowboys, forajidos, sheriffs, camareras, buscadores de oro y otros personajes del viejo oeste".
Según cuentan, de niño no parecía muy inteligente, y, por si fuera poco, hablaba a medias, debido a un leve defecto en el habla.
Ello no impidió a este físico danés, obtener el premio Nobel de Física por sus contribuciones a la explicación de la estructura de los átomos.
|
Propiedades mn = 1,7 10-27 kg qn = 0 |
Actividad
El neutrón es una partícula constituyente del átomo que tiene:
- una masa similar a la del protón.
- No tiene carga eléctrica. es una partícula neutra.
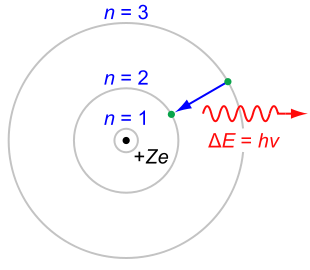 |
| Imagen de dominio público. Modelo atómico de Bohr. |
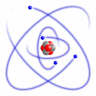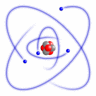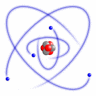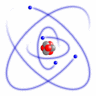
- Primer postulado: El átomo está constituido por una parte central, el núcleo, en la que se localizan los protones y neutrones, por tanto tiene la carga positiva y casi toda la masa. En torno a este núcleo, en la corteza, giran los electrones en órbitas circulares de manera que compense la atracción por parte del núcleo.
- Segundo postulado: El electrón sólo puede orbitar alrededor del núcleo en ciertas órbitas estacionarias, en las que no irradia energía. Es decir, sólo son posibles determinadas órbitas, en las que los electrones pueden encontrarse de forma estable, que se sitúan alrededor del núcleo como las capas de una cebolla. Las órbitas más estables, de menor energía son las más próximas al núcleo, aumentando la energía del electrón, cuando se sitúa en las más exteriores.
- Tercer postulado: Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados intermedios, esto implica la correspondiente emisión o absorción de energía, normalmente en forma de radiación luminosa. Cuando un electrón salta de un nivel a otro, la energía (absorbida o emitida) se corresponde con la diferencia de energía entre ambas órbitas. Por lo tanto, la emisión o absorción de energía por parte del átomo, solo tiene lugar a unas frecuencias concretas, y además las frecuencias de emisión y de absorción son idénticas.
Actividad
|
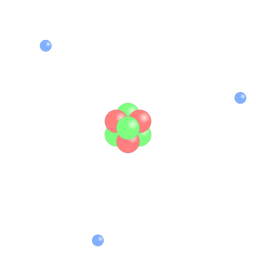
| Imagen de dominio público. |
Bohr establece un modelo según el cual, el átomo está constituido por el núcleo, donde se encuentran los protones y neutrones y la corteza, donde orbitan los electrones en determinadas órbitas estacionarias, que se distribuyen en capas como en una cebolla. Los electrones pueden pasar de unas órbitas a otras, emitiendo o absorbiendo radiación electromagnética.
Pronto se vio que este modelo tenía algunas dificultades, por lo que fue necesario introducir nuevas correcciones a fin de salvarlas.
El modelo atómico
resultante se conoce como Modelo Atómico de Bohr-Sommerfeld e incluye
las siguientes correcciones:
| Pueden existir, junto a las órbitas circulares, órbitas elípticas para los electrones, de manera que para cada valor del nivel energético, automáticamente quedaba fijado el número de posibles órbitas (circulares o elípticas). Es decir, eran posibles diferentes formas para las órbitas del electrón dentro de una capa, que posteriormente se designaron mediante las letras: s, p, d, f... Esto viene a significar que en un nivel energético, puede haber varios subniveles. |
Otra corrección supone que para las órbitas elípticas
son posibles
varias
orientaciones espaciales, resultando diferentes órbitas para el
electrón, todas con idéntica energía.
|
| Finalmente se encontró que son posibles dos estados para el electrón que se encuentra en una órbita determinada, dicho de otra forma, en una órbita pueden encontrarse hasta dos electrones. |
Actividad
|
| Animación licencia GNU |
El átomo está formado por un núcleo central, donde se encuentran los protones y los neutrones, y a su alrededor, en la corteza, en órbitas estacionarias, se sitúan los electrones. Estas órbitas pueden ser circulares o elípticas y tener diferentes orientaciones, y en cada una de ellas pueden situarse como máximo dos electrones.
Pre-conocimiento
¿Sabias que la mayoría de las propiedades químicas de los elementos dependen mucho de los electrones que tiene en la última capa?.
Así pues, es importante, para poder predecir las propiedades de un elemento, conocer cómo se distribuyen los electrones en los niveles y subniveles del átomo, es decir, de su configuración electrónica. Así, conociendo la configuración electrónica de un átomo, podremos predecir con bastante fiabilidad cuáles serán sus propiedades.
Para comprender mejor cómo se expresa la configuración electrónica es muy útil la siguiente animación, que muestra la configuración electrónica de los diferentes elementos:
|
|
| Iniciación Interactiva a la materia. Animación de Mariano Gaite Cuesta |
Para expresar la configuración electrónica, basta con indicar el número de electrones que tiene en cada capa y como el orden en que se van llenando las órbitas es tan particular, podemos utilizar la animación anterior y finalmente contar el número de electrones en cada nivel.
AV - Actividad de Espacios en Blanco
Pregunta Verdadero-Falso
Retroalimentación
Falso
Retroalimentación
Falso
Retroalimentación
Verdadero
Retroalimentación
Verdadero