3.- Modelo atómico de Rutherford
Pre-conocimiento

|
|
Imagen de dominio público.
|
¿Sabías que Ernest Rutherford era hijo de un granjero y mecánico de Nueva Zelanda?. Desde muy joven destacó como un brillante estudiante, lo que le permitió conseguir las becas para continuar sus estudios. Así consiguió finalizarlos en el Reino Unido, donde prosiguió su actividad investigadora.
A Rutherford, se le considera el padre de la Física nuclear e hizo grandes contribuciones al mundo de la Física. Obtuvo el premio o Nobel de Química, y no el de Física, por sus aportaciones que ayudaron a comprender la estructura de la materia.
Según el modelo de Thomson, el electrón es una partícula constituyente del átomo, que tiene carga negativa. Pues si el electrón es negativo y es un componente del átomo, que es neutro neutro, es de esperar que en el átomo se encuentren también otras partículas con carga positiva.
Pues si las cargas negativas son partículas, electrones, ¿por qué no van a ser también partículas las cargas positivas?
|
Propiedades mp = 1,7 10-27 kg qp = + 1,6 10-19 C |
Desde luego que no transcurrieron muchos años hasta que se encontrara esta nueva partícula, el protón. Se atribuye a Rutherford el descubrimiento del protón, una partícula con una masa muy grande, comparada con la del electrón (mp = 1,7 10-27 kg) y una carga exactamente igual a la del electrón, pero de signo positivo (qp = 1,6 10-19 C).
Actividad
El protón es una partícula constituyente del átomo, que tiene:
- Carga positiva y de igual valor a la del electrón.
- Una masa mucho mayor a la del electrón, unas dos mil veces.
Actividad de Lectura
Descubierta otra partícula subatómica, el protón, se tuvo de nuevo la necesidad de idear un modelo para el átomo, a fin de comprender cómo están situados los protones y los electrones en el interior del diminuto átomo.
Rútherford, realizó un sencillo experimento que le permitió establecer un nuevo modelo. Pulsa en el botón que hay más abajo para ver un vídeo subtitulado donde se muestra dicho experimento.
 |
|
Imagen de dominio público. |
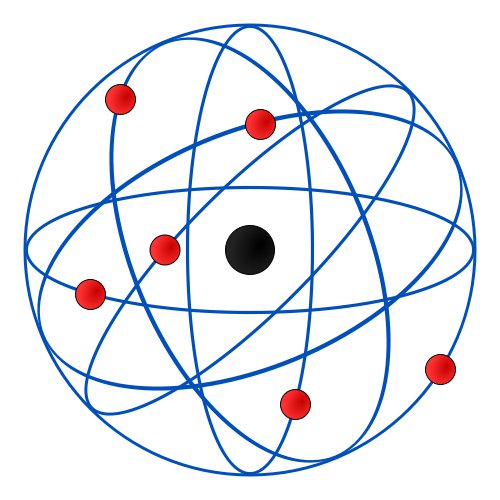
El átomo está constituido por un núcleo central en el que se encuentra localizada la casi totalidad de la masa y toda la carga positiva. En torno a este núcleo y a grandes distancias (relativas) de él se encuentran los electrones girando a gran velocidad para que se compense la fuerza de atracción electrostática por el núcleo positivo.
Además con objeto de que el átomo sea eléctricamente neutro, la carga
positiva del núcleo ha de ser exactamente igual a la carga de los electrones. Es decir, el número de protones del núcleo es el mismo que el de electrones de la corteza.
Actividad
Así pues, Este modelo resulta revolucionario, por varios aspectos:
- El átomo está constituido por dos partes, el núcleo, donde se encuentra toda la carga positiva y casi toda la masa y la corteza donde orbitan los electrones.
- Considera que el átomo está prácticamente vacío, pues, alrededor del minúsculo núcleo, giran, a grandes distancia, los diminutos electrones, resultando la mayor parte del espacio del átomo vacío.
- El modelo predice la existencia de una partícula aún no descubierta, el neutrón:
- Si en el núcleo se encuentra casi toda la masa, y en él se encuentran los protones solamente, debe faltar algo muy pesado en el núcleo, pues los átomos tiene mayor masa que la de los protones que hay en el núcleo.
- El modelo establece que en el núcleo se encuentran los protones. Pero ¿Cómo en un espacio tan pequeño, van a encontrarse sólo los protones, que son positivos?, tiene que haber algo más, que compense las repulsiones entre los protones en el núcleo y permita explicar su estabilidad.
Actividad de Lectura
- Cuando Rutherford postuló el modelo, no se conocía la existencia de los neutrones, por lo que estos no son considerados en el modelo. Por tanto no queda explicada adecuadamente la estructura del núcleo de los átomos.
- La Teoría electromagnética dice que una carga acelerada emite energía en forma de radiación electromagnética. Por lo que el electrón, que en este caso posee la aceleración radial (por describir una órbita circular alrededor del núcleo), debe emitir energía. Pero al emitir energía, el electrón debe hacerlo a costa de su propia energía cinética, lo cual originaría que fuera acercándose progresivamente al núcleo, cayendo finalmente a él. Por tanto, y según este modelo, el átomo no sería estable.
- Hay una continuidad en el átomo, es decir, es posible cualquier estado energético, lo cual entra en contradicción con algunas propiedades atómicas que se ponen de manifiesto cuando se estudian los espectros atómicos.
AV - Actividad de Espacios en Blanco
Completa el siguiente texto con las palabras que faltan: