2.- Modelo atómico de Thomson
Pre-conocimiento
Con este modelo tan simple de Dalton, podían explicarse de manera satisfactoria todas las leyes de la Química que se conocían. Pero pronto se encontraron evidencias de que este estupendo y simple modelo no era capaz de explicarlo todo.
La acción de la corriente eléctrica sobre las sustancias hace que se descompongan en iones, los cuales tiene carga eléctrica. ¿De dónde sale esa carga eléctrica?. Si los átomos son pequeñas esferas, sin carga, la carga eléctrica sólo puede explicarse por la ruptura de los átomos, por la acción de la electricidad. Pero, si con la electricidad se rompe el átomo, ya hay algo más pequeño, y por tanto, el átomo no será ni indivisible ni indestructible.
 |
| Imagen de dominio público. |
Thomson, a finales del siglo XIX, realizó varios experimentos con los tubos de rayos catódicos, que le permitieron descubrir una partícula más pequeña que el átomo, el electrón.
¿No sabes lo que son los tubos de rayos catódicos?, ¿los de los viejos televisores?, pues si es así, pulsa en este enlace a la wikipedia donde te explicarán muy bien lo que es. Pero no entres en muchas profundidades, que los rayos catódicos no son el objetivo de estudio de este tema.
|
|
| Iniciación Interactiva a la materia. Animación deMariano Gaite Cuesta |
En la anterior animación puedes observar que al aplicar una diferencia de potencial entre los extremos se produce la emisión de radiacción, en forma de luz verde, y que ésta se trasmite en línea recta. Esta radiacción se denominó rayos catódicos, por proceder del cátodo. Esto lo puedes observar pulsando el botón Apagar/Encender tubo. También puedes observar, pulsando en el botón Aplicar/quitar campo, que al aplicar un campo eléctrico, o magnético, sobre la trayectoria de los rayos, éstos se devían, lo que indica claramente que se trata de partículas cargadas negativamente.
Tras el estudio detallado de las desviaciones producidas en los tubos de rayos catódicos, se encontró que se trataba de partículas cargadas negativamente y fácilmente desviables (de poca masa). Se pudieron describir las características de un diminuto electrón.
|
Propiedades me = 9,1 10-31 kg qe = - 1,6 10-19 C |
Se encontró que el electrón era una partícula con una masa extremadamente pequeña, exactamente 9,1 10-31 kg. También se encontró que el electrón tenía una carga eléctrica negativa, con un valor de 1,6 10-19 C.
El culombio (C) es la unidad de carga eléctrica en el Sistema Internacional de Unidades. Se define como la cantidad de carga que pasa por la sección de un conductor eléctrico en un segundo, cuando la corriente eléctrica es de un amperio, y se corresponde con la carga de 6,24 × 1018 electrones.
Actividad
El electrón es una partícula constituyente del átomo, caracterizada por:
- Carga eléctrica negativa.
- Masa extremadamente pequeña.
|
|
Imagen de dominio público.
|
| |
|
Imagen de dominio público. |
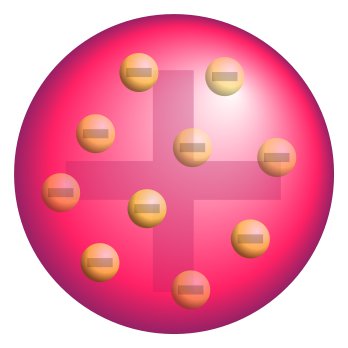
Pues si el electrón es una partícula constituyente del átomo, ¿cómo son los átomos por dentro?.
Thomson ideó un modelo del átomo en el que suponía que era como una esfera de electricidad positiva y que los electrones, cargados negativamente, estaban encajados en ella, la en cantidad suficiente como para neutralizar la carga positiva.
Este primer modelo sobre la estructura interna del átomo, se conoce como "Pudin de pasas", pues los electrones están incrustados como las pasas en un pudin.
Actividad
Actividad de Espacios en Blanco
La siguiente frase describe el átomo propuesto por Thomson, escribe las palabras que faltan.