1.1 Geometría molecular: modelo RPECV
Las estructuras electrónicas de Lewis no explican la geometría de las moléculas. Por ejemplo, la molécula de agua se suele representar en línea (H-O-H), pero eso no significa que sea lineal.
La geometría molecular se refiere a la disposición tridimensional de los átomos de una molécula. Para determinar la geometría de las moléculas o de las redes covalentes se utiliza una teoría publicada en 1970 por Gillespie, llamada VSEPR (Valence Shell Electron Pair Repulsion), o de repulsión de los pares de electrones de la capa de valencia (RPECV).
No es un modelo de enlace, pues no explica la formación de enlaces: parte de las estructuras de Lewis, a las que aplica unas sencillas reglas para obtener la geometría correspondiente. Esas reglas se basan en la repulsión entre pares de electrones, que son interacciones puramente electrostáticas y son las siguientes:
1. Los pares de electrones se sitúan lo más lejos posible entre ellos para que la repulsión sea mínima.
2. Los pares sin compartir (no enlazantes) repelen a los compartidos (enlazantes) más que al revés, ya que necesitan más espacio al ser menos direccionales por no formar enlaces.
3. Los enlaces múltiples repelen a los sencillos más que al revés, ya que tienen mayor número de electrones.
Para aplicar esta teoría, los pasos que deben seguirse son los siguientes:
- Escribir la estructura de Lewis correspondiente. (Si una molécula tiene dos o más estructuras resonantes, es posible aplicar el modelo RPEVC a cualquiera de ellas).
- Fíjate en el número de pares de electrones enlazantes y no enlazantes en el átomo central y observa, en la siguiente tabla, cuál sería la geometría en la que la repulsión es mínima. (Al considerar los pares electrónicos, los dobles y los triples enlaces se deben tratar como si fueran enlaces sencillos).
 |
| Imagen 6 Elaboración propia |
Objetivos
La RPECV en la web
La página del profesor Enrique de Jesús recoge todos los casos posibles, no sólo los más importantes, que son los que aparecen en la imagen anterior.
Tiene un especial interés al visualizar las moléculas animadas en 3D. Si no las ves en tu ordenador, sigue las instrucciones que te indica para instalar el plugin Chime.
Ejemplo o ejercicio resuelto
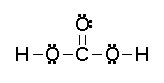 |
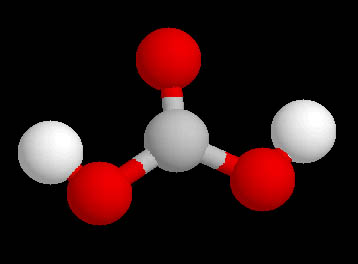 |
| Imagen 7 Elaboración propia | Imagen 8 Elaboración propia |
Observa la estructura de Lewis y el modelo molecular del ácido carbónico. Justifica:
a) La geometría molecular.
b) ¿Qué enlace de los que forma el C será el más corto?
c) ¿Qué ángulo OCO es más pequeño?
Aplica las reglas del modelo RPECV.
AV - Reflexión
Representa la estructura de Lewis del dióxido de carbono, molécula simétrica, y deduce su geometría aplicando las reglas de la teoría de RPECV.