2. Aplicaciones de la electrolisis
La electrolisis posee muchas aplicaciones de interés industrial y comercial. Entre éstas hay que nombrar la obtención de metales y productos químicos industriales importantes, la refinación del cobre y la galvanoplastia.
Síntesis electrolítica del aluminio
| Vídeo 3 Cosmolearning, Uso libre |
Una gran cantidad de metales y productos químicos industriales importantes se obtienen por electrolisis (aluminio, sodio, flúor, cloro, hidróxido sódico,etc).
El método de producción del aluminio no es precisamente moderno, ya que el método industrial utilizado es el proceso Bayer, que fue patentado por Karl Bayer en 1889. La bauxita, utilizada como materia prima, se transforma en alúmina, Al2O3, que se utiliza para producir aluminio mediante electrólisis según el proceso denominado de Hall-Heroult. Para ello se disuelve en un baño fundido de criolita (Na3AlF6) y se electroliza en una celda electrolítica usando electrodos de carbono, siendo la reacción producida:
2 Al2O3 → 4 Al (l) + 3 O2 (g)
Puedes ver el proceso en el vídeo.
Por el elevado punto de fusión, el consumo energético necesario para obtener aluminio es muy elevado y lo convierte en uno de los metales más caros de obtener, resultando mucho más rentable el reciclado del mismo (¡hay que reciclar las latas de refrescos!).
 |
| Imagen 16 Henning, Dominio público |
Recubrimientos metálicos
La galvanoplastia es una de las aplicaciones más importantes. Consiste en aplicar una delgada capa de metal sobre una superficie conductora de corriente: el cromado da a los metales una superficie brillante, el acero se galvaniza con cinc para protegerlo de la corrosión, los metales se platean o doran por galvanoplastia, etc.
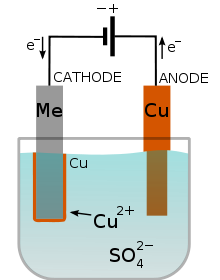
El objeto que va a recubrirse hace de cátodo en el circuito, y se sumerge en un baño electrolítico que contiene los iones que se desea depositar. Controlando la intensidad de la corriente y el tiempo de electrolisis se puede fijar el espesor y cantidad de capa depositada.
En la imagen puedes ver el cobreado de un metal: se oxida el cobre del ánodo, que pasa en forma de iones a la disolución, y se deposita en el cátodo sobre el metal a recubrir de cobre.