3.4. Molaridad
Pre-conocimiento
 ¿Te acuerdas del mol?, se podía definir, tanto desde el punto de vista microscópico, en función del número de partículas que contiene, como a nivel macroscópico, en función del la masa.
¿Te acuerdas del mol?, se podía definir, tanto desde el punto de vista microscópico, en función del número de partículas que contiene, como a nivel macroscópico, en función del la masa.
Pues en este apartado sólo utilizaremos la definición macroscópica: un mol contiene una masa en gramos, igual a la masa molar.
 |
| Imagen de CNICE, uso educativo |
La molaridad, también llamada a veces concentración, mide en número de moles de soluto que hay por cada litro de disolución (mol/L).
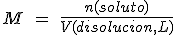
Como mide la cantidad de soluto por litro de disolución, se determina fácilmente sabiendo la composición en g/L: para pasar la masa a cantidad de sustancia no hay más que dividir por la masa molar del soluto.
De esta forma, si una disolución de hidróxido de sodio tiene una concentración de 0.5 mol/L, esto significa que hay disueltos 0.5 moles de NaOH en cada litro de disolución.
Actividad
La molaridad (o concentración) de una disolución, indica el número de moles de soluto que hay disuelto por cada litro de disolución.
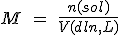
Conocida la concentración molar de una disolución, puede utilizarse como factor de conversión para relacionar el número de moles de soluto y el volumen de disolución.
Por ejemplo, una disolución de hidróxido de sodio cuya concentración sea 2 mol/L, tiene 2 moles de hidróxido sódico por cada litro de dislución, por lo tanto podemos utilizar los factores de conversión:
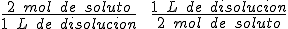
El primero lo utilizaremos para calcular los moles de soluto que hay en una determinada cantidad de disolución y el segundo cuando queramos determinar el volumen de disolución conociendo el número de moles de soluto presentes.
AV - Reflexión
 |
| Banco de imagenes del ITE |
El ácido clorhídrico comercial está disponible en disolución del 37 % en masa y tiene una densidad de 1,18, y una masa molar de 36,5 g/mol, ¿cuál es la concentración molar del ácido clorhídrico comercial?.