3.1. Modelo atómico de Bohr
Los espectros discontinuos ponen de manifiesto el carácter discreto de la radiación emitida por los gases incandescentes. ¿Qué es lo que ocurre en el interior de los átomos para que veamos los espectros a rayas?, ¿cómo se emite la radiación?. Esta pregunta vuelve a estar relacionada con el asunto que hemos tratado hasta ahora en este tema.
Para resolver esta cuestión, Niels Bohr (1885-1962) se dio cuenta que la teoría clásica era incapaz de dar una respuesta correcta, y optó por aplicar la idea de los cuantos de Planck para interpretar el espectro del hidrógeno proponiendo, en 1913, un nuevo modelo atómico que se resume en los siguientes postulados:
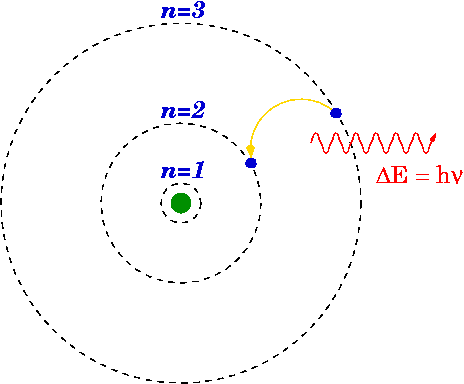
- Los electrones se mueven en ciertas órbitas permitidas alrededor del núcleo sin emitir radiación. Así Bohr asumió que el átomo de hidrógeno puede existir solo en ciertos estados discretos, los cuales son denominados estados estacionarios del átomo. En el átomo no hay emisión de radiación electromagnética mientras el electrón no cambia de órbita.
- El átomo radia cuando el electrón hace una transición (“salto”) desde un estado estacionario a otro, es decir toda emisión o absorción de radiación entre un sistema atómico está generada por la transición entre dos estados estacionarios. La radiación emitida (o absorbida) durante la transición corresponde a un cuanto de energía (fotón) cuya frecuencia f está relacionada con las energías de las órbitas estacionarias por la ecuación de Planck (E=hf) y está determinada por la relación :
![]()
donde h es la constante de Planck (6.626 10-34J·s ), con Ei y Efson las energías de los estados estacionarios iniciales y finales de la transición electrónica.
|
|
|
Imagen en Wikimedia Commons de WilloW |
- Las órbitas estacionarias admisibles son aquellas en las que el momento angular orbital L (L=mvr) del electrón está cuantizado, pudiendo este asumir solamente valores múltiplos enteros de L=nh/2Π, donde h es la constante de Planck y n es un número natural (1,2,3,..), llamado número cuántico principal. Así,
![]()
En el siguiente vídeo puedes ver una simulación de las órbitas permitidas en el modelo de Bohr, así como el mecanismo de emisión y absorción de radiación que se produce cuando el electrón salta de unas órbitas a otras.
| Vídeo de jmrroquin1956 alojado en Youtube |
Para saber más
El momento angular de una partícula es una magnitud física que se define como el producto vectorial de su momento lineal (![]() ) y el vector de posición. Es decir:
) y el vector de posición. Es decir:
![]()