4. Resumen
Importante
Los átomos son los componentes básicos de la materia y están divididos en corteza (donde se encuentran los electrones) y núcleo (formado por los protones y neutrones).
En un átomo neutro el número de protones y electrones es el mismo.
Al número de protones de un átomo se le llama número atómico (Z) y es el mismo para todos los átomos del mismo tipo.
A la suma del número de protones y en número de neutrones de un átomo se le llama número másico (A) y puede ser distinto incluso en átomos del mismo tipo. Esos átomos con el mismo Z y distinto A se dice que son isótopos.
Las moléculas son agrupaciones de un número determinado de átomos del mismo o de distinto tipo.
Las moléculas se representan mediante una fórmula en la que se indica qué tipo de átomos la forman y cuántos átomos de cada tipo contiene.
 |
| Molécula de nitrógeno Imagen de cdr en Wikimedia. Dominio público |
Importante
El comportamiento de las partículas (átomos o moléculas) que forman un cuerpo es explicado por el modelo cinético-molecular:
- Las partículas que forman un cuerpo ejercen fuerzas unas sobre otras.
- Las partículas que forman un cuerpo no están juntas. Entre ellas hay espacio vacío.
- Las partículas que forman un cuerpo están en incesante movimiento, tanto más deprisa cuanta mayor es la temperatura del cuerpo.
La materia puede estar en tres estados de agregación, según el tipo de partículas que la formen y la temperatura a la que se encuentre.
En cada estado de agregación la materia tiene propiedades diferentes y sus moléculas se comportan de forma diferente:
| Los sólidos | Los líquidos | Los gases |
|
|
|
Calentado o enfriando un cuerpo lo suficiente, se puede conseguir que el cuerpo cambie de estado. Los cambios de estado quedan resumidos en la siguiente imagen:
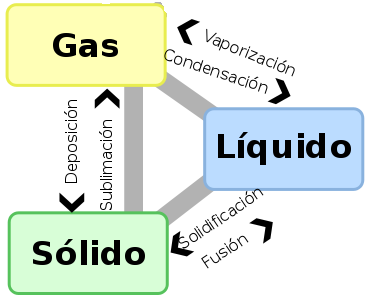 |
| Imagen de UAwiki en Wikimedia Commons. Dominio público |
Importante
A la hora de clasificar la materia se suele hacer dividiéndola en sustancias puras y mezclas.
Las sustancias puras tienen una composición fija e invariable, poseen propiedades características y no pueden descomponerse en otras más elementales por procedimientos físicos sencillos.
Las sustancias puras las podemos clasificar a su vez en elementos (formadas por un solo tipo de átomos) y compuestos (formados por varios tipos de átomos combinados químicamente).
Las mezclas se forman cuando se juntan varias sustancias pero sin reaccionar químicamente.
Las mezclas se pueden clasificar en homogéneas o disoluciones (misma composición y mismo aspecto en todas partes) y heterogéneas (se distinguen los componentes a simple vista).
Una disolución es una mezcla homogénea de sustancias puras formada por un disolvente (componente que está en mayor proporción) y uno o varios solutos.
De forma cualitativa podemos determinar la concentración de una disolución: cuando en una disolución hay muy poco soluto, la disolución es diluida; si la proporción de soluto es considerable se dice que es concentrada y si ya hemos alcanzado la máxima cantidad de soluto que se puede disolver, la disolución está saturada.
De forma cuantitativa podemos expresar la concentración de una disolución de varias formas. Tres de ellas son las siguientes:
- Concentración en % en masa: es la cantidad de gramos del componente que encontramos en 100 g de disolución.
- Concentración en % en volumen: es la cantidad de mililitros del componente que encontramos en 100 ml de disolución.
- Concentración en gramos por litro: es la cantidad de gramos del componente que encontramos en un litro de disolución.
Los componentes de las mezclas heterogéneas se pueden separar por medios mecánicos (filtración, atracción magnética o tamizado) y los de las mezclas homogéneas por medio de cambios de estado.