1.1. Los átomos
Estructura atómica.
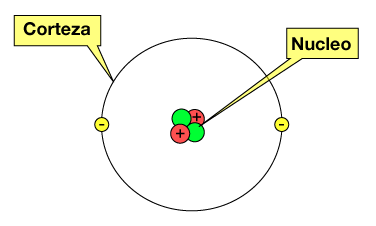
Los átomos son los componentes básicos de la materia. Un átomo está constituido por:
- Una corteza, donde se encuentran los electrones (con carga eléctrica negativa).
- Un núcleo, que es la parte central del átomo, formado por los protones y neutrones.
En el núcleo se concentra aproximadamente el 99.99% de la masa total del átomo y tiene carga positiva.
|
|
| Imagen de elaboración propia |
Importante
Los átomos son los componentes básicos de la materia y están divididos en corteza (donde se encuentran los electrones) y núcleo (formado por los protones y neutrones).
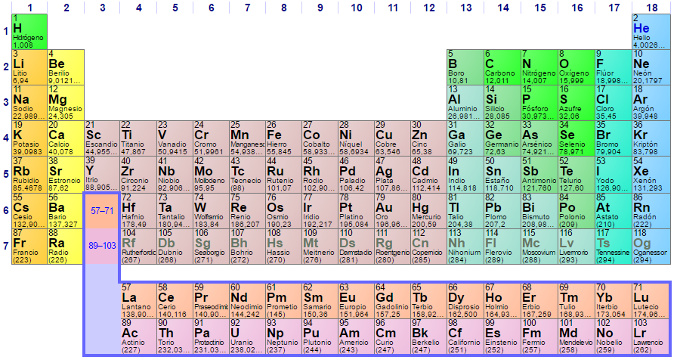
En la naturaleza hay 92 tipos de átomos diferentes (y otros cuantos más obtenidos de forma artificial). Cada uno de ellos tiene su nombre y se representan con un símbolo . Por ejemplo, el oxígeno es la O, el hidrogeno la H, el sodio Na, el cloro Cl, el carbono C, el calcio Ca...
Los símbolos de todos los átomos se agrupan en la tabla periódica que es está convenientemente organizada en función de las propiedades de los elementos.
 |
| Imagen de Tximitx en Wikimedia Commons. Licencia CC |
Junto al símbolo, en cada casilla de la tabla periódica aparece un número (arriba a la izquierda), por ejemplo, el 1 en el H (hidrógeno) o el 8 en O (oxígeno). Es el número atómico y nos dice el número de protones que todos los átomos de ese tipo tienen en su núcleo. Se representa por la letra Z.
Normalmente los átomos son neutros, tienen el mismo número de cargas eléctricas positivas que negativas, es decir, tienen el mismo número de electrones que de protones.
Caso práctico
Por ejemplo…
Fíjate en la casilla del carbono; el número atómico del carbono es Z = 6. Pues bien, esto significa que todos los átomos de carbono del Universo tienen seis protones en su núcleo. No encontraremos un átomo de carbono que tenga 5 protones. Un átomo con cinco protones será, necesariamente, un átomo de boro.
Si el átomo de carbono es neutro también tendrá 6 electrones.
Neutrones. Número másico
Aunque todos los átomos de un mismo tipo tienen siempre el mismo número de protones, no sucede lo mismo con el número de neutrones.
Por ejemplo, hay átomos de carbono que tienen 6, 7 e incluso 8 neutrones. Pero esto no afecta a que sean átomos de carbono (porque tienen 6 protones)
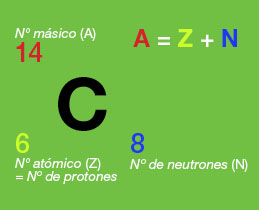
Al número conjunto de protones y neutrones de un átomo (a la suma de los dos) se le llama número másico y se representa por la letra A.
Una forma habitual de ofrecer toda la información sobre un átomo (símbolo, número de protones, número de electrones y número de neutrones) es escribirlo así:
 |
| Imagen de elaboración propia |
Por ejemplo, en la imagen se representa un átomo de carbono 14, que tiene 6 protones y 8 neutrones. Su número másico es, por tanto, 6 + 8 = 14.
Dos átomos del mismo tipo, con el mismo número de protones, pero que tengan distinto número de neutrones, se dice que son isótopos.
Importante
El número atómico (Z) nos dice el número de protones que cada átomo en su núcleo.
El número másico (A) es el conjunto de protones y neutrones de un átomo (la suma de los dos).
Dos átomos del mismo tipo se dice que son isótopos si tienen el mismo número de protones pero distinto número de neutrones.