3. Ecuaciones termoquímicas y diagramas energéticos
Pre-conocimiento
¿Recuerdas el tema 3 de esta unidad?. Cálculos estequiométricos, en él aprendiste a obtener las proporciones en que se combinan o se fornan las distintas sustancias participantes en una reacción química.
Las cantidades de sustancias que reaccionaban o se formaban en una reacción química, las podías obtener a partir de la ecuación química ajustada.
Ahora además vamos a incluir el calor de reacción en las ecuaciones químicas, con lo que no sólo podrás calcular la cantidad de sustancia que reacciona o se forma, ahora también podrás calcular la cantidad de calor intercambiada.
Así pues, podremos determinar la energía necesaria o liberada cuando reacciona determinada cantidad de sustancia, un aspecto de mucho interés en nuestros días, en los que la energía es un recurso caro y escaso.
Si en una ecuación química detallas el calor intercambiado, estás escribiendo una ecuación termoquímica. Fíjate cómo se escribe en el caso de la formación de agua:
H2(g) + ½ O2(g) → H2O(g) ; Qr = –241,4 kJ
Come ves, la ecuación química tiene que estar ajustada, es decir, tiene que haber el mismo número de átomos de cada clase en los reactivos y en los productos. Y el calor de de reacción, que se escribe a la derecha , separado por un punto y como, tiene que ir acompañado de su signo, que indica si la reacción es endotérmica o exotérmica. Así en la ecuación termoquímica anterior, se liberan 241,4 kJ cuando reacciona 1 mol de H2 con 0,5 moles de O2, formándose 1 mol de H2O.
A veces también te los puedes encontrar el calor insertado en la ecuación química con un signo más, como si se tratara de otro reactivo o producto más, a la izquierda en las reacciones endotérmicas (hay que aportarlo) y a la derecha en las exotérmicas (se desprende), por ejemplo en la reacción anterior, se podría representar de la siguiente manera:
H2(g) + ½ O2(g) → H2O(g) + 241,4 kJ
El calor de reacción depende de la cantidad de sustancia que reacciona o que se produce. Por tanto, si se ajusta poniendo coeficientes dobles, habrá
que multiplicarlo por 2, ya que reacciona el doble de sustancia y lógicamente se intercambiará el doble de energía:
Actividad
Diagramas energéticos
En la reacción anterior el calor es negativo, por lo que la variación total de energía es negativa, es decir, el agua tiene menos energía que entre el oxígeno y el hidrógeno.
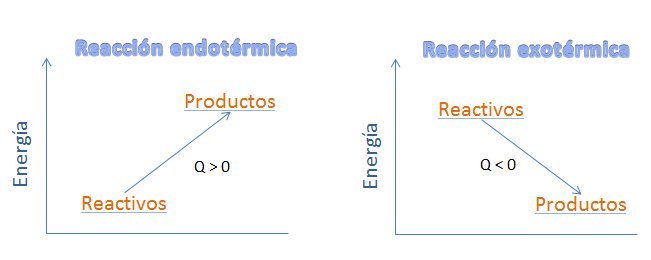
Se suelen representar diagramas energéticos para dar una idea gráfica del contenido energético de reactivos y productos. En la imagen puedes ver tanto un proceso exotérmico como el anterior, como uno endotérmico, en los que se representan los niveles de energía química de reactivos y productos
 |
| Imagen de elaboración propia |
En el caso de procesos exotérmicos, en los que se produce un desprendimiento de energía, esa energía se invierte en aumentar la temperatura del propio sistema, por lo que se observa un calentamiento.
Si se trata de procesos endotérmicos, la energía absorbida por el sistema es a costa de disminuir la temperatura del propio sistema, observándose un enfriamiento.
AV - Reflexión
Es fácil que tengas en casa alcohol de quemar (metanol) o bien disolvente de laca de uñas (acetona). Vas a realizar una pequeña experiencia con ellos: deja caer unas gotas del líquido de que dispongas en el dorso de la mano, y espera a que se evapore.
a) ¿Se trata de un proceso físico o químico?
b) El líquido ¿es poco volátil o muy volátil?
c) ¿Qué sensación has tenido al evaporarse el líquido?
d) Deduce el carácter térmico del proceso (si es endo o exotérmico).
e) Justifica tu respuesta basándote en interacciones entre moléculas.