2. Calor de reacción
Pre-conocimiento
 |
| Imagen de manuelfloresv, licencia CC |
¿Calorías o kilocalorías?
Cuando hablamos de alimentos, no está muy claro esto de las calorías y las kilocalorías, pues a veces se pone una cosa y otras veces otra. Es frecuente hablar de una dieta baja en calorías, de una dieta de 2000 calorías...
La caloría se define como la cantidad de calor necesaria para elevar un grado la temperatura de un gramo de agua.
Hasta hace poco se admitía otra unidad, la caloría grande o caloría-kilogramo que representaba la energía calorífica necesaria para aumentar la temperatura de un kilogramo de agua. Esta definición equivale exactamente a la kilocaloría. El problema es que esta unidad se empleó mucho en Biología, Medicina y Nutrición, y se le asignaba el símbolo "Cal" (con C mayúscula) para diferenciarla de la caloría propiamente dicha, de símbolo "cal". Así que hay que tener cuidado para no confundirse, pues aparece en multitud de documentos y referencias, expresando en calorías (calorías grandes), lo que entendemos como kilocalorías. Por tanto una dieta de 2000 Cal es una dieta con valor energético de 2000 kilocalorías.
 |
| Imagen de Harbor1, Creative commons |
El calor intercambiado en una reacción química se puede medir experimentalmente mediante dispositivos tales como la bomba calorimétrica, en la que se calcula el calor desprendido midiendo la variación de temperatura producida en la reacción.
En el cilindro metálico de la bomba calorimétrica de la imagen se introducen los reactivos para que tenga lugar la reacción química, y a partir de la variación de temperatura que se produce, se determina fácilmente el calor intercambiado en la reacción química.
No obstante, no existe un procedimiento sencillo y general para medir el trabajo intercambiado en una reacción química.
Y es que, como has visto, tanto el calor como el trabajo que se intercambian en una reacción química, dependen de los enlaces químicos que se rompen y se forman en el transcurso de la reacción. Pero, de este intercambio energético, ¿qué parte es trabajo y qué parte es calor?, ¿no es siempre lo mismo?.
Pues el que haya intercambio de calor y de trabajo, dependerá de cómo sea el sistema, el recipiente donde tiene lugar la reacción química.
 |
| Imagen de elaboración propia |
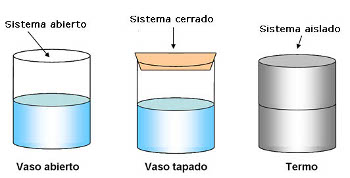
Al establecer el sistema, nos podemos encontrar con diferentes casos, en función de que se pueda o no intercambiar materia y energía con el medio.
- Sistema aislado: no hay intercambio ni de materia ni de energía con el medio. No se intercambia calor, ni tampoco trabajo pues no hay variación de volumen.
- Sistema cerrado: No hay intercambio de materia, peri sí de energía. Puede haber intercambio de calor, pero no de trabajo, pues el volumen es constante y como sabes el trabajo se debe a los cambios de volumen.
- Sistema abierto: puede haber intercambio de materia y energía con el medio. En este caso puede haber intercambio de calor y de trabajo con el medio.
Resumiendo, el intercambio energético de una reacción química, va a depender de los enlaces químicos que se rompan y se formen en la misma, y para determinarlo experimentalmente, mediremos el calor intercambiado con una bomba calorimétrica. El problema es que calor intercambiado va a depender de cómo sea el sistema en el que se lleva a cabo la reacción química, pues en algunos casos puede haber intercambio de trabajo, en cuyo caso será a costa del intercambio de calor.
Por eso es muy importante, a la hora de hablar de calores de reacción, establecer las condiciones en que se lleva a cabo la reacción, pues de ellas dependerá su valor.
Quizás lo más sencillo fuera obtener el calor de reacción en un sistema cerrado, en el que, al ser el volumen constante, no hay intercambio de trabajo, pero el problema es que hay reacciones explosivas, que ocurren con un gran cambio de volumen y para las que sería muy difícil construir un recipiente que soportara la presión alcanzada. Así que el el criterio adoptado para establecer los calores de reacción es llevarlas a cabo a presión constante, que es como ocurren habitualmente en la naturaleza, en recipientes abiertos.
Objetivos
 |
| imagen de elaboración propia |
Al calor intercambiado en una reacción química, cuando ésta ocurre a presión constante, se le denomina variación de entalpía, o simplemente, entalpía y se le representa por ΔH.
Si además, la reacción se lleva a cabo a la presión constante de 1 atmósfera y a la temperatura de 25 ºC (condiciones estándar), al calor de reacción se le denomina variación de entalpía estándar, o simplemente, entalpía estándar y se la representa por ΔHº.
Si de una reacción química nos indican su entalpía (ΔH) lo que nos están dando es el calor intercambiado en esa reacción cuando ocurre a presión constante. Si lo que nos indican es su entalpía estándar (ΔHº), lo que nos están dando es el calor intercambiado cuando se lleva a cabo a la temperatura de 25ºC y 1 atm de presión.
Pues de esta forma, ΔH ó ΔHº, es como te encontrarás habitualmente representado el calor de reacción, y recuerda, se trata del calor intercambiado en la reacción a presión constante o en condiciones estándar, respectivamente.
Como ya has visto, en las reacciones endotérmicas se requiere un aporte de energía para que ocurran y en las exotérmicas en cambio se libera energía mientras ocurren, es decir, hay reacciones en las que es necesario aportar calor y otras que lo liberan.
Para indicar si el calor es liberado o, por el contrario, es necesario aportarlo, se utiliza un signo positivo o negativo, que por convenio es: positivo para las reacciones endotérmicas, en las que hay que aportar calor para que ocurran y negativo para las reacciones exotérmicas, en las que se desprende calor.
Actividad
El calor de reacción es el intercambiado cuando la reacción se lleva a cabo a presión constante y puede ser:
- Positivo: si se trata de una reacción endotérmica, que absorbe calor, que es necesario aportarlo.
- Negativo: si se trata de una reacción exotérmica, que desprende calor, que lo libera.
 |
| Imagen de Caesiumfluoride, Creative commons |
Los calores de reacción también reciben el nombre del tipo de la reacción química que corresponda y hay dos tipos de reacciones químicas muy interesantes en Termoquímica: las reacciones de formación y las reacciones de combustión:
Llamamos calor de formación de una sustancia, al calor intercambiado en la reacción en la que se forma un mol de sustancia a partir de sus elementos en el estado más estable.
Con unos ejemplos lo entenderás mejor:
- El Calor de formación del agua líquida es -285,8 kJ/mol. Esto quiere decir que se liberan 285 kJ en la reacción en la que se forma un mol de agua líquida a partir de sus elementos (hidrógeno y oxígeno) en el estado más estable (dihidrógeno y dióxígeno).
H2(g) + 1/2 O2(g) → H2O(l).Como ves, la ecuación se ajusta poniendo coeficiente estequiométrico unidad al agua líquida, ya que el calor de formación se define por mol de sustancia formada. - El calor de formación del etano (C2H6) es de -84,7 kJ/mol. Significa que se desprenden 84,7 kJ en la reacción química en la que se forma un mol de etano gaseoso a partir de sus elementos en el estado más estable, carbono e hidrógeno:
2 C(s) + 3 H2(g) → C2H6(g).
El calor de combustión de una determinada sustancia, se define como el calor intercambiado en la reacción de combustión, es decir, la reacción con oxígeno gaseoso, de un mol de sustancia. Las reacciones de combustión más importantes son las de los compuestos de carbono, en las que todo el carbono que tienen se transforma en dióxido de carbono (CO2) y todo el hidrógeno en agua (H2O).
Mira estos ejemplos:
- El calor de combustión del metano (CH4) es de -802 kJ/mol. Esto significa que cuando se quema un mol de metano (16 g), se desprende un calor de 802 kJ. La reacción de combustión es aquella en la que 1 mol de metano (CH4) reacciona con oxígeno para formar dióxido de carbono (CO2) y agua (H2O):
CH4 + 2 O2 → CO2 + 2 H2O.
Como ves, la reacción se ajusta poniendo coeficiente unidad a la sustancia que reacciona con oxígeno, al CH4. - El calor de combustión del butano (C4H10) es de -2875,8 kJ/mol. Esto quire decir que cuando arde un mol de butano (C4H10) con oxígeno (O2), se produce dióxido de carbono (CO2) y agua (H2):
C4H10 + 13/2 O2 → 4 CO2 + 5 H2O.
|
|
| Vídeo subido por |
Como ves, una reacción de formación es aquella en la que se forma la sustancia a partir de sus elementos y la de combustión, aquella en la que la sustancia reacciona con oxígeno, dando lugar a los óxidos de los elementos que lo forman (CO2 y H2O, en los compuestos de carbono).
Pero las reacciones de combustión no sólo las producen los compuestos de carbono, en el vídeo que se muestra a la izquierda, puedes observar una reacción de combustión de un metal, el magnesio. La reacción que tiene lugar es la siguiente:
Mg(s) + 1/2 O2(g) → MgO(s)
Esta reacción es además exotérmica, en ella se desprenden 601 kJ.
Por eso podemos decir que el calor de combustión del Magnesio es de -601 kJ/mol.
Pero por otra parte, esta es una reacción de formación, es la reacción de formación del óxido de magnesio a partir de sus elementos, magnesio y oxígeno, por lo que tammbién podemos decir que el calor de formación del óxido de magnesio es de -601 kJ/mol
Actividad
Calor de formación estándar:
Es el calor intercambiado en una reacción a presión constante cuando se obtiene un mol de una sustancia a partir de sus elementos en el estado que presentan en condiciones estándar, 25 ºC y 1 atm.
Calor de combustión estándar:
Es el calor intercambiado en la reacción de combustión de un mol de sustancia, cuando la reacción se lleva a cabo en condiciones estándar, a 25 ºC y 1 atm de presión.
AV - Reflexión
Escribe y ajusta las ecuaciones químicas que representan:
a) La reacción de formación del etanol líquido.
b) La reacción de combustión del etanol.
Como ves, estos calores de reacción se definen por mol de sustancia que reacciona y por eso se miden es en J/mol, no obstante, también se utilizan otras unidades como la cal/mol y también los múltiplos de éstas: kJ/mol y kcal/mol, ya que las unidades anteriores son demasiado pequeñas para las cantidades que se intercambian en las reacciones químicas. La relación de entre estas unidades, como sabes, es la siguiente:
1 cal/mol = 4,18 J/mol
1 kJ/mol = 1 000 J/mol
1 kcal/mol = 4 180 J/mol