1. Energía química
Pre-conocimiento
| Vídeo de Youtube subido por escvangels |
La Termodinámica es la parte de las ciencias físico-químicas que estudia los flujos de energía en general. La termodinámica se desarrolla con la máquina de vapor, por la necesidad de mejorar el rendimiento. El funcionamiento básico de la máquina de vapor es muy sencillo, se trata de un sistema que transforma en trabajo, parte del calor que se le da.
Como puedes observar en el vídeo, el funcionamiento se debe a que el calor que se le da produce vapor de agua, y la evaporación conlleva un gran aumento de volumen, responsable del trabajo que produce la máquina. Ten en cuenta que 1 litro de agua líquida al evaporarse, ocupa un volumen del orden de 1600 litros.
En el caso que ahora interesa, que son las reacciones químicas, se suele hablar de Termoquímica o Termodinámica Química.
Cuando estudiamos un determinado proceso, como por ejemplo una reacción química, el sistema termodinámico, se aísla de su entorno y el estado se define por los valores de determinadas variables, llamadas variables de estado, que son magnitudes físicas medibles (P, V, T y composición). El sistema evoluciona termodinámicamente cuando hay un cambio en alguna de estas variables de estado.
Con este ejemplo lo entenderás mejor, para un médico el sistema es el enfermo, que está aislado del exterior en hospitales (UCI). El estado del enfermo lo determina el valor de unas constantes físicas (temperatura, ritmo cardíaco, presión sanguínea, composición de la sangre y de la orina, etc), de forma que la evolución de la enfermedad viene dada por el cambio de esos parámetros.
En el caso de una reacción química, para su estudio se la aísla en un recipiente y las variables de estado son la composición, la presión, la temperatura y el volumen. Con el transcurso de la reacción varía la composición (pues unas sustancias se transforman en otras diferentes), puede haber variación de temperatura (si se libera o se absorbe energía), puede haber variación de volumen o de presión (si se produce variación en la cantidad de sustancias gaseosas).
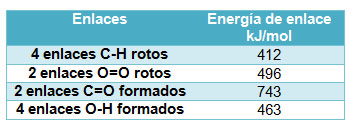
Como ya sabes, una reacción química consiste en la transformación de una o varias sustancias iniciales, llamadas reactivos en otras distintas, denominadas productos, esto supone la ruptura de enlaces en las las sustancias reaccionantes y la creación de otros nuevos enlaces para dar lugar a nuevas sustancias. Como no todos los enlaces tienen la misma fuerza de unión entre los átomos (no tienen la misma energía de enlace), ni tampoco se crean y se rompen el mismo número de enlaces, la reacción tiene lugar siempre con variación de energía.
La energía química es una medida de la energía de interacción entre los átomos unidos y está relacionada con la distribución electrónica y el tipo de enlace que tenga lugar entre ellos. A la energía necesaria para romper un mol de enlaces se le llama energía de enlace. Naturalmente, al formarse un mol de enlaces se desprende la misma energía que hay que comunicar para romperlo, al tratarse de procesos contrarios.
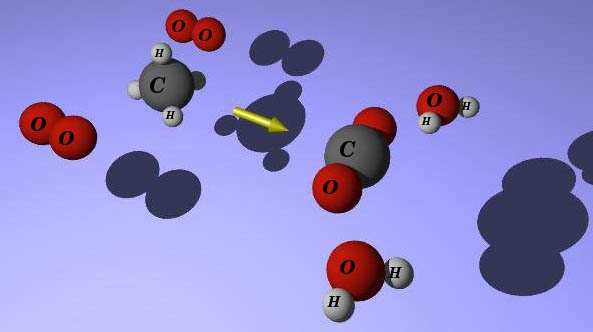
En la imagen puedes ver la combustión del metano. En la tabla siguiente se indica qué enlaces se rompen y cuáles se forman. Es necesario que recuerdes las estructuras de enlace en las sustancias que intervienen en el proceso.
Fíjate en la imagen. En el metano, el C está unido a cuatro H. Como al final está unido a dos oxígenos, hay que romper cuatro enlaces C-H, y también dos dobles enlaces O=O en las dos moléculas de oxígeno, O2. Además, se forman dos enlaces dobles C=O (en el CO2) y cuatro enlaces O-H en las dos moléculas de agua.
 |
 |
| Imagen de D.Gaya, Dominio público | Imagen de elaboración propia |
Si la energía que hay que comunicar para romper los enlaces que mantienen unidos los átomos es mayor que la que se desprende cuando se forman los nuevos enlaces, en conjunto habrá que comunicar energía, y la reacción será endotérmica. En el caso contrario, se tratará de una reacción exotérmica y en el transcurso de la misma se liberará energía. El hecho de que una reacción sea endo o exotérmica se debe a si hay que comunicar más o menos energía para romper los enlaces en los reactivos de la que se desprende cuando se forman los nuevos enlaces en los productos.
Actividad
- Reacción endotérmica: es necesario aportar energía para que ocurra, pues la energía requerida para romper los enlaces es mayor que la que se libera al formarse los nuevos enlaces.
- Reacción exotérmica: libera energía cuando ocurre, pues la energía necesaria para romper los enlaces es menor que la que se libera al formarse los nuevos enlaces.
En Termoquímica, al estudiar los intercambios de energía en las reacciones químicas, nos interesan dos formas de transferir energía:
- Calor: Cuando ponemos en contacto dos cuerpos que están a distinta temperatura, se produce una transmisión de energía en forma de calor del cuerpo de mayor temperatura (caliente) al de menor temperatura (frío).
- Trabajo: Cuando se aplica al sistema una fuerza capaz de provocar un desplazamiento, lo que se está intercambiando es trabajo. En las reacciones químicas se intercambia trabajo cuando se producen variaciones en el volumen, por ejemplo si varía la cantidad de sustancias gaseosas.
Motor explosión
Animación del ITE. LicenciaCC
Por ejemplo, en una reacción química como la que ocurre en un cilindro de un motor de explosión, en la que se quema gasolina y los gases desprendidos a alta presión y temperatura desplazan el émbolo del cilindro, produciendo trabajo. Además, en el transcurso de la reacción el motor se calienta, ya que se libera también calor.
Son muchos los procesos químicos que cuando ocurren conllevan un intercambio de energía, es decir, producen un intercambio de calor y de trabajo, que es muy importante conocer y cuantificar, a fin de poder utilizarlo como recurso energético. Pero recuerda que estos intercambios son consecuencia de los enlaces químicos rotos y formados en el transcurso de la reacción química.
Tanto el calor como el trabajo se miden en las mismas unidades que la energía, en el Sistema Internacional de Unidades, en julios (J), aunque también es frecuente medirlas en calorías (cal), recuerda que la relación entre estas dos unidades es muy sencilla:
1 cal = 4,18 J
Actividad
Las dos formas en que un sistema puede intercambiar energía con el medio son:
- Calor: la energía se transfiere en virtud de una diferencia de temperatura.
- Trabajo: la energía se transfiere en por la aplicación de una fuerza que se desplaza.
Para medirlos se utiliza el julio (J), aunque también es frecuente utilizar la caloría (cal).
1 cal = 4,18 J