4.3. Números cuánticos
Ya has visto en el apartado anterior que la forma de los orbitales puede ser bastante compleja. Cada uno de estos orbitales (que resultan de resolver la ecuación de Schrödinger) queda caracterizado por tres números, llamadas números cuánticos. En resumen, mientras el modelo de Bohr se bastaba con un sólo número (n) para describir las órbitas que podía ocupar el electrón, ahora se requieren los siguientes tres números cuánticos:
- Nº cuántico principal (n): puede tomar valores enteros (1, 2, 3...) y coincide con el mismo nº cuántico introducido por Bohr. Está relacionado con la distancia promedio del electrón al núcleo en un determinado orbital y, por tanto, con el tamaño de este e indica el nivel de energía.
- Nº cuántico secundario (ℓ): puede tener todos los valores desde 0 hasta n – 1. Está relacionado con la forma del orbital e indica la energía dentro de cada nivel. Además debes saber que, según sea el valor de ℓ los orbitales se representan con una letra diferente, esta es la relación
| Valor de ℓ | Orbital |
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | f |
- Nº cuántico magnético (mℓ): puede tener todos los valores desde - ℓ hasta + ℓ pasando por cero. Describe la orientación espacial del orbital e indica el número de orbitales presentes en un subnivel determinado.
Pero además de estos tres números cuánticos, existe un cuarto número que está relacionado con una propiedad de los electrones llamada momento angular intrínseco o espín. No vamos a profundizar mucho en él, pero sí te indico que la existencia del espín fue contrastada en un experimento realizado en 1922 por los físicos alemanes O. Stern y W. Gerlach.
En este experimento se hacía pasar átomos neutros por un campo magnético variable y se observaba que el haz de átomos se desdoblaba en dos, correspondientes con las dos posibles orientaciones del electrón debidas a su espín, paralela o antiparalela al campo magnético exterior. Gracias a esto se pueden realizar diagnósticos por medio de resonancias magnéticas nucleares. Lo siguiente es una simulación del experimento de Stern Gerlach.
|
|
|
Simulación de Jubobroff en Wikimedia Commons . CC |
Esto hace que en cada uno de los orbitales anteriores puedan alojarse hasta dos electrones, cuya diferencia está en su valor del espín.
- Nº cuántico de espín ms, caracteriza este momento angular intrínseco y puede tener sólo los valores 1/2 ó -1/2.
En resumen, el estado de un electrón en el interior de un átomo queda completamente definido si son conocidos los cuatro números cuánticos (n, ℓ, mℓ, ms) de tal forma que, en un átomo, no pueden existir dos electrones con los mismos valores de los cuatro números cuánticos. A este resultado se le conoce con el nombre de principio de exclusión de Pauli.
Caso práctico
Escribe todos los posibles números cuánticos correspondientes a los orbitales 4d.
Objetivos
UN ZOO DE PARTÍCULAS. EL MODELO ESTÁNDAR
Electrones, protones y neutrones no bastan para explicar las interacciones nucleares.
Se debe afinar más y profundizar en el dominio de la física cuántica. Protones y neutrones no son partículas elementales sino que están formadas por tres quarks cada uno (el protón está formado por 2 quark up y 1 quark dow, el neutrón está formado por 2 quark down y 1 quark up) y que, además, hay que añadir una propiedad a las ya conocidas, el espín.
Cuando se tiene en cuenta el espín, la materia puede clasificarse en dos grandes grupos:
- Fermiones: Partículas con espín semientero. Los fermiones satisfacen el principio de exclusión de Pauli. El ejemplo más conocido es el electrón (ms=±1/2).
- Bosones: Partículas con espín entero. Los bosones no satisfacen el principio de exclusión de Pauli. El ejemplo más conocido es el fotón (ms=1).
Esta clasificación es la base del modelo estándar de la física de partículas.
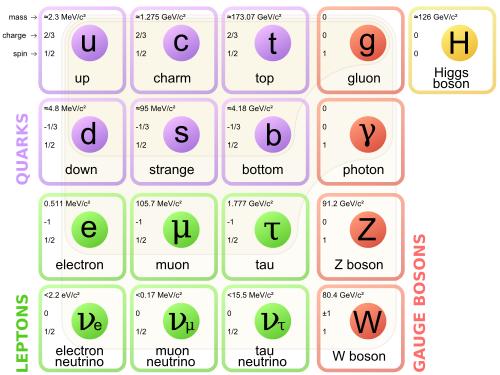
|
Imagen en Wikimedia Commons de Cush bajo licencia Creative Commons |
El modelo estándar es una teoría que describe las partículas elementales que componen la materia y las interacciones que se establecen entre ellas. La tabla anterior resume las 17 partículas conocidas de acuerdo con este modelo.
Doce de estas 17 partículas son los fermiones, casi se puede decir que son las partículas de materia y digo "casi" por si aparece alguna otra, recuerda siempre habrá lago que descubrir. Esas partículas interaccionas entre sí dando lugar a los fenómenos conocidos del electromagnetismo, la gravedad o las interacciones nucleares fuerte y débil.
Según el modelo estándar cada una de esas interacciones se produce a través del intercambio de partículas, los bosones. Por ejemplo, el fotón es el responsable de la interacción electromagnética, el gluón de de la interacción fuerte y los bosones Z y W de la interacción débil. Y esto sin mencionar el bosón de Higg (partícula capaz de explicar los orígenes de la masa de otras partículas elementales) o la dificultad de encontrar una explicación para el intercambio de bosones en la interacción gravitatoria.
En definitiva, como ves, todo un zoológico de partículas.