Descripción de la tarea

El peróxido de hidrógeno, también conocido como agua oxigenada, es un compuesto químico que por lo general se presenta como un líquido ligeramente más viscoso que el agua y que tiene un gran carácter oxidante.
El peróxido de hidrógeno se encuentra en bajas concentraciones en muchos productos domésticos. En la industria, el peróxido de hidrógeno se usa en concentraciones más altas para blanquear telas y pasta de papel, y al 90% como componente de combustibles para cohetes y para fabricar espuma de caucho y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas enzimas, como la catalasa. Y en la vida cotidiana, seguro que te suena el utilizar esta sustancia para desinfectar heridas o decolorar el pelo.
El uso del agua oxigenada como desinfectante en heridas se debe a que, al contacto con sangre, se descompone y desprende oxígeno. En esta tarea vamos a estudiar esta reacción y algunas características de la misma relacionadas con la velocidad de reacción.
|
|

1.- Define el concepto de velocidad de reacción e indica las unidades en las que generalmente se suele expresar.
A partir de resultados experimentales, se obtuvo la siguiente gráfica, que muestra la variación de concentración del agua oxigenada en función del tiempo.
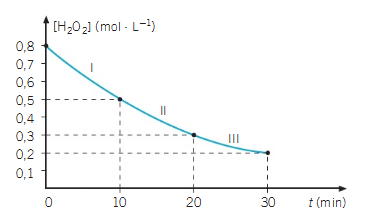
2.- ¿Cuál será la velocidad media de descomposición del agua oxigenada en los intervalos I, II y III?
3.- Se sabe que la ecuación de velocidad de esta reacción es de orden cero. Escríbela e indica las unidades de la constante de velocidad. ¿Qué significa que se trata de una reacción de orden cero?
Estamos considerando que la reacción en cuestión transcurre en una etapa pero, la mayoría de las reacciones transcurren en varias etapas. El conjunto de estas etapas se conoce como mecanismo de la reacción. Las sustancias que van apareciendo en estas etapas y que no son los productos finales se conocen como intermedios de reacción. En estos casos, la velocidad de la reacción dependerá de las sustancias que transcurran en la etapa más lenta.
Imagina que estás trabajando con la siguiente reacción elemental de un mecanismo más complejo:
![]()
Para determinar la ecuación de velocidad de forma experimental lo que se hace es medir la velocidad inicial manteniendo las concentraciones de todos los reactivos constantes excepto la de uno y ver cómo afecta la variación de éste al valor de la velocidad.
Supón que los datos obtenidos son los siguientes:
| Experiencia | [A] (mol/L) | [B] (mol/L) | v (mol·L-1·s-1) |
| 1 |
0.25 |
0.25 | 3.71 |
| 2 | 0.50 | 0.25 | 7.42 |
| 3 | 0.25 | 0.50 | 14.84 |
4.- Determina los órdenes de reacción total y parciales, así como el valor de k para el caso anterior.
5.- Indica y comenta brevemente los dos modelos teóricos que explican a nivel molecular lo que ocurre al producirse una reacción química e interpretan la rapidez o lentitud de una reacción.
6.- Indica los factores que pueden influir en la velocidad de una reacción.
Se ha comprobado que el agua oxigenada se descompone muy lentamente a temperatura ambiente. Sin embargo, como has podido comprobar en el vídeo, al entrar en contacto con la sangre, la descomposición es muy rápida.
7.- Explica la función de la sangre en esta reacción e investiga qué otras sustancias podrían utilizarse para el mismo fin.
8.- Indica un proceso industrial y un proceso biológico en los que se empleen catalizadores. Indica también el tipo de catalizador que se utiliza y su finalidad.
![]()
En esta tarea vas a trabajar cuestiones relacionadas con la cinética química que pueden volver a aparecer en la tarea global.