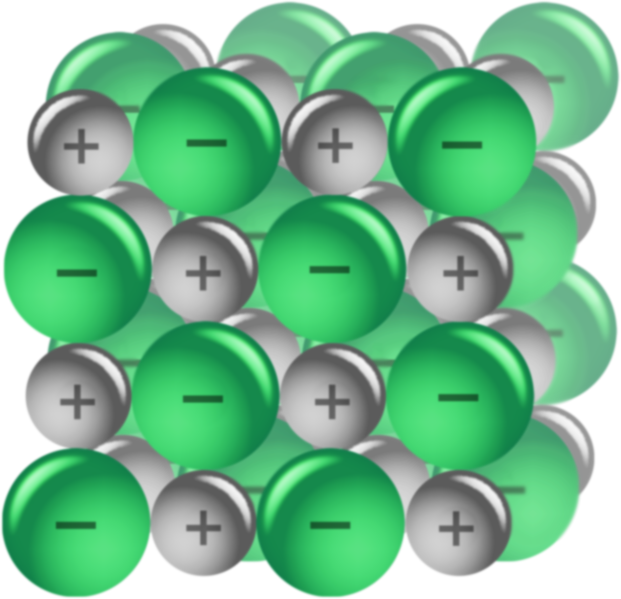
4.2. Enlace iónico
Actividad
Se forma al reaccionar un elemento metálico —de los grupos I, II y III salvo el boro— con otro elemento, no metálico —de los grupos V, VI y VII.
Me está pareciendo muy interesante, ¿qué opinas tú?
Mira una representación simplificada de la tabla periódica. En ella puedes observar como los elementos presentan un mayor carácter metálico cuanto más hacia la izquierda y más hacia abajo se encuentren (pica en metal-no metal).
¿Podrías decir, mirando una tabla periódica, qué elemento resulta más metálico, el sodio o el cloro?
- Los metales son en general son buenos conductores de calor, de la electricidad y tienen brillo; piensa en un anillo de oro.
- Los no metales, entre otras cosas, se caracterizan por ser malos conductores del calor y la electricidad, y no tienen brillo; piensa en el polvo de azufre.
AV - Pregunta Verdadero-Falso
Retroalimentación
Falso
Retroalimentación
Verdadero
Retroalimentación
Falso
Pertenecen los dos a los no metales, su unión no es por enlace iónico.
Retroalimentación
Verdadero
 |
|
|
enlace_ionico Vídeo de profevirtualinh alojado en YouTube |
Imagen en Wikimedia commons de Aka bajo licencia Creative Commons |
 |
|
Imagen en Wikimedia commons de Ingvald Straume bajo licencia Creative Commons.
|
Caso de estudio
Como hemos escuchado en el video, este enlace presenta, además de alta dureza, otras características: son cristalinos, frágiles, tienen elevados puntos de fusión y ebullición y pueden conducir la electricidad. Si quieres ver cómo puedes comprobar en casa este hecho, pincha en el enlace y verás un experimento fácil, que podrás hacer.