6. Formulación y nomenclatura
Ya has trabajado la formulación y nomenclatura en 1º de Bachillerato, tanto de compuestos inorgánicos como del carbono. Ahora se trata de que revises esos conocimientos que ya tienes, con el objetivo de que sepas formular y nombrar cuando te resulte necesario a lo largo del curso.
No se trata de que tengas que trabajar con sustancias muy complejas, sino de que no tengas dificultades con sustancias tan habituales como el ácido clorhídrico (HCl), el ácido sulfúrico (H2SO4), el hidróxido de sodio (NaOH), el carbonato de calcio (CaCO3), el nitrato de potasio (KNO3), el butano (CH3-CH2-CH2-CH3), el etanol, (CH3-CH2OH) o el ácido acético (CH3-COOH).
Recuerda que en las combinaciones binarias, para que el compuesto resultante sea neutro cada elemento llevará como subíndice el número de oxidación del otro elemento, en valor absoluto (el subíndice 1 se omite). En los compuestos iónicos, estos subíndices se pueden simplificar, pero esto no puede hacerse en los compuestos covalentes.
A la hora de formular una sustancia, debes tener en cuenta que el átomo que aparece más a la derecha en una combinación binaria se corresponderá con el átomo que aparece antes en el siguiente esquema (desde donde empieza la flecha, en el flúor). Debes tener en cuenta que este esquema es el que ha establecido la IUPAC para la formulación, pero no se corresponde con el orden real de electronegatividades:
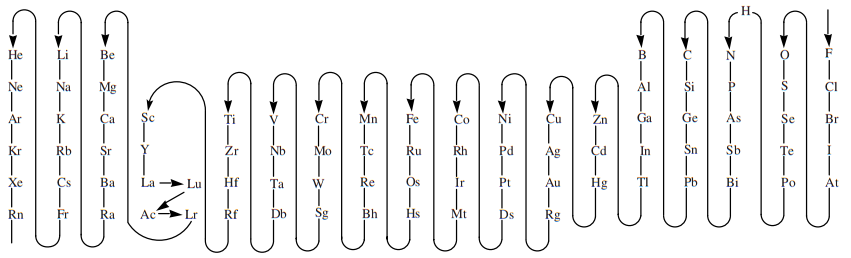
Vas a ver a continuación una tabla con ejemplos de formulación de compuestos inorgánicos habituales (óxidos, hidróxidos, hidruros, ácidos y sales). Fíjate que en los ejemplos aparece una de las nomenclaturas que puede utilizarse según en caso y el nombre común entre paréntesis.
| Función | Descripción |
Ejemplos |
|
| Sustancias simples | Formadas por átomos de un mismo elemento. | H2 | Dihidrógeno (hidrógeno) |
| H | Monohidrógeno (hidrógeno atómico) | ||
| P4 | Tetrafósforo (fósforo blanco) | ||
| Fe | Hierro | ||
| Iones* |
Son átomos o agregados de átomos con carga eléctrica, positiva en el caso de los cationes y negativa en aniones. | K+ | Ion potasio (1+) (Ion potasio) |
| H3+ | Ion trihidrógeno (1+) | ||
| N3- | Ion nitruro (3-) (Ion nitruro) | ||
| N3- | Ion trinitruro (1-) (Ion azida) | ||
|
Hidruros metálicos |
Formados por el anión H-, que actúa con número de oxidación -1, y un metal. | LiH | Hidruro de litio |
| AlH3 | Hidruro de aluminio | ||
| FeH3 | Trihidruro de hierro | ||
| Hidruros no metálicos |
Combinaciones del H y el O u otros elementos de los grupos 13, 14 y 15 (que son más electropositivos que el H). | H2O | Monóxido de dihidrógeno (agua) |
| NH3 | Trihidruro de nitrógeno (amoniaco) | ||
| CH4 | Tetrahidruro de carbono (metano) | ||
| Ácidos hidrácidos |
Combinaciones del H (que actúa con número de de oxidación +1) con los no metales de los grupos 16 (S, Se y Te, con número de oxidación -2) y 17 (F, Cl, Br y I, con número de oxidación -1). | HCl | Cloruro de hidrógeno o ácido clorhídrico (en disolución acuosa) |
| HF | Fluoruro de hidrógeno o ácido fluorhídrico (en disolución acuosa) | ||
| HS2 | Sulfuro de hidrógeno o ácido sulfhídrico (en disolución acuosa). | ||
| Óxidos | Constituidos por oxígeno (con número de oxidación -2) y un metal o un no metal. El orden en la fórmula dependerá del orden en el que aparezcan los elementos según el diagrama anterior. | FeO | Monóxido de hierro |
| CO2 | Dióxido de carbono | ||
| O5Cl2 | Dicloruro de pentaoxígeno | ||
| Hidróxidos |
Formados por el grupo OH-, que actúa con número de oxidación -1, y un metal. |
NaOH | Hidróxido de sodio |
| Ni(OH)3 | Trihidróxido de níquel | ||
| NH4OH | Hidróxido de amonio | ||
| Sales binarias | Formados por un catión monoatómico con un anión monoatómico. | KI | Yoduro de potasio |
| AgBr | Bromuro de plata | ||
| FeCl3 | Tricloruro de hierro | ||
| Ácidos oxoácidos | Son compuestos ternarios formados por hidrógeno (que actúa con número de oxidación +1), oxígeno (que actúa con número de oxidación -2) y un no metal o un metal de transición con elevado número de oxidación (que actúa con número de oxidación positivo). | HClO | Hidrogeno(oxidoclorato)/ (Ácido hipocloroso) |
| HClO4 | Hidrogeno(tetraoxidoclorato)/(Ácido perclórico) | ||
| H2SO4 | Dihidrogeno(tetraoxidosulfato)/(Ácido sulfúrico) | ||
| Oxoaniones (tipo particular de iones*) |
Son aniones procedentes de los oxoácidos; resultan de la pérdida total o parcil de los H+ en los oxoácidos. | ClO- | Monoxidoclorato(1-)/ (Ion hipoclorito) |
| HSO4- | Hidrogeno(tetraoxidosulfato)(1-)/ (Ion hidrogenosulfato) | ||
| SO42- | Tetraoxidosulfato(2-)/ (Ion sulfato) | ||
| Oxosales | Combinaciones de un catión metálico (o ion amonio) y un oxoanión. | KMnO4 | Permanganato de potasio |
| K2Cr2O7 | Dicromato de potasio | ||
| Ca(ClO3)2 | Clorato de calcio | ||
Objetivos
La forma más sencilla de revisar la formulación y la nomenclatura de las sustancias es utilizar los materiales de Física y Química de 1º de Bachillerato. Si no, también hay algunas páginas que te pueden ayudar:
- Página de Carlos Alonso para formulación inorgánica: http://www.alonsoformula.com/inorganica/
- Página de Rafa FyQ, del IES Sierra de Mijas: Ejercicios de formulación inorgánica resueltos.
En cuanto a los compuestos del carbono, ahora solamente es necesario que recuerdes los aspectos fundamentales:
- Los hidrocarburos están formados por carbono e hidrógeno.
- Su nombre tiene un prefijo que depende del número de átomos de carbono (1-met, 2-et, 3-prop, 4-but, 5-pent, 6-hex, etc).
- El sufijo depende del tipo de compuesto: -ano para hidrocarburos con enlaces sencillos, -eno si hay enlaces dobles, -ino si hay enlaces triples.
- Los alcoholes tienen grupos -OH, y llevan el sufijo -ol.
- Los ácidos tienen grupos -COOH y llevan el sufijo -oico.
- Las cadenas carbonadas pueden tener ramificaciones (grupo metilo -CH3, grupo etilo -CH2-CH3).
- Se indica la posición de los grupos característicos y de las ramificaciones.
- Si hay varios grupos o sustituyentes, se indica con prefijos di, tri, etc.
| Función | Descripción |
Ejemplos |
|
| Alcanos |
Formados por C e H, con C unidos por enlaces sencillos R-CH3 |
CH3-CH2-CH3 | Propano |
| CH3-CH2-CH2-CH3 | Butano | ||
| Alquenos |
Formados por C e H, con al menos dos C unidos por enlace doble R-CH=CH2 |
CH2=CH2 | Eteno (etileno) |
| CH3-CH=CH2-CH3 | 2-buteno | ||
|
Alcoholes |
Además de C y H, contienen el grupo OH R-OH |
CH3-CH2-CH2OH | 1-propanol |
| CH2OH-CH2-CH=CH2 | 3-propen-1-ol | ||
| Ácidos |
Además de C y H, contienen el grupo COOH R-COOH
|
CH3-COOH | Ácido etanoico(acético) |
| COOH-CH2-COOH | Ácido propanodioico | ||
Si quieres repasar algo más la formulación orgánica, puedes hacerlo en este enlace.