1. La constante en los equilibrios heterogéneos
| Simulación 1 Proyecto TIGER, Uso educativo |
En los equilibrios heterogéneos, alguno de los reactivos o productos es un sólido o un líquido puro, como puedes ver en los ejemplos de la tabla. Ahora bien, la concentración de un sólido o líquido puro coincide con su densidad a una temperatura determinada, y por lo tanto, es constante. Estas constantes se engloban dentro de la constante de equilibrio, cuya expresión queda notablemente más sencilla.
Fíjate en el primer ejemplo, en el que la expresión de la constante de equilibrio real Kreal sería:
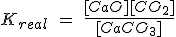
Pero como [CaO] y [CaCO3] son constantes, pasan a la izquierda, de forma que la Kc resulta ser solamente la [CO2].
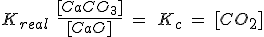
Observa en la simulación cómo al añadir o quitar CaO o CaCO3, sustancias sólidas, no cambia la presión en el recipiente, ya que las cantidades de sólidos no influyen en el equilibrio, y hay la misma cantidad de CO2.
| Equilibrio heterogéneo | Expresión de Kc | Expresión de Kp |
| CaCO3 (s) ↔ CaO (s) + CO2 (g) | 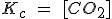 |
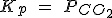 |
| 2 Hg (l) + O2 (g) ↔ 2 HgO (s) | 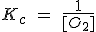 |
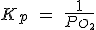 |
| FeO (s) + CO (g) ↔ Fe(s) + CO2(g) | 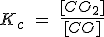 |
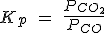 |
| CO2(g) + C (s) ↔ 2 CO (g) | 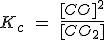 |
 |
Actividad
La constante en los equilibrios heterogéneos
En la expresión de la constante de equilibrio de los equilibrios gaseosos o en disolución no se incluyen los sólidos o líquidos puros.
Ejemplo o ejercicio resuelto
Indica la expresión de la constante de equilibrio para la reacción de formación del disulfuro de hidrógeno a diferentes temperaturas:
a) A 1000 ºC: S (g) + H2 (g) ↔ H2S (g)
b) A 200 ºC: S (l) + H2 (g) ↔ H2S (g)
c) A -100 ºC: S (s) + H2 (g) ↔ H2S (s)