Descripción de la tarea

1. [Prueba Junio 2009]El ozono es un gas cuyas moléculas están constituidas por tres átomos de oxígeno. Esta sustancia nos protege de la radiación ultravioleta solar. En 250 gramos de dicho gas:
- ¿cuántos moles hay?
- ¿cuántas moléculas?
- ¿cuántos átomos?
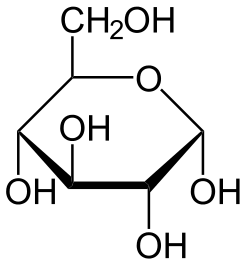
2.La glucosa es un monosacárido de fórmula C6H12O6 es el compuesto orgánico más abundante en la naturaleza. Las personas que sufren diabetes deben controlar su cantidad en sangre. En ayunas una persona debe tener 100mg de glucosa por cada decilitro de sangre.
|
|
|
Datos: masas atómicas de los elementos utilizados:
H = 1 g/mol ; O = 16 g/mol ; C = 12 g/mol
3. [Prueba Junio 2010]El amoniaco a temperatura ambiente es un gas incoloro y de olor picante característico. ¿Cuántos átomos de hidrógeno hay en 2 moles de amoniaco?
4. En la cocina de nuestras casas estamos rodeados de múltiples compuestos químicos que normalmente manejamos en cantidades alejadas de las magnitudes usuales en un laboratorio (una cucharada, un vaso, etc). Completa la siguiente tabla para llegar a conocer cuántos átomos de estas sustancias están contenidas en esas cantidades.
| Cantidad | Equivalencia en gramos | Fórmula Molecular | Nº de moles | Número de moléculas |
| Pizca de sal |
0,5 g | NaCl | ||
| Vaso de agua |
225 g | H2O | ||
| Cucharada de aceite | 15 g | C18H34O2 | ||
| Cucharadita de vinagre | 5 g | CH3COOH |
Datos: Masas atómicas de los elementos utilizados:
H = 1 g/mol ; Na = 23 g/mol ; C = 12 g/mol ; Cl = 35,5 g/mol ; O = 16 g/mol
5. [Prueba Septiembre 2013] ¿Dónde hay más moléculas, en 17 g de amoniaco (NH3) o en 29 g de butano (C4H10)? Razona la respuesta.
Datos: Masas atómicas de los elementos utilizados:
H = 1 g/mol ; N = 14 g/mol ; C = 12 g/mol

A la hora de resolver la tarea, debes elaborar un documento con el resultado de la tarea y enviárselo a tu profesor/a. Puedes utilizar esta plantilla para su desarrollo, aunque también puedes elaborar tu propia plantilla. Si haces esto último, debes indicar el enunciado de cada uno de los apartados previo a su resolución. Recuerda, al guardar la plantilla en tu ordenador, cambiar el nombre al documento incluyendo tu nombre y apellidos siguiendo este modelo Apellido1_Apellido2_Nombre_PACQU_U1_T2
Si quieres elaborar esquemas o dibujos, puedes hacerlos manualmente, escanearlos e insertarlos en el documento de texto.