5. Sustancias puras: elementos y compuestos
|
Recuerda Una sustancia pura es aquella de la que no se pueden separar diferentes componentes por procedimientos físicos.
|
 Hemos vistos que si una sustancia pura no puede descomponerse en otras por procedimientos químicos es un elemento. Esto es debido a que los elementos están formados por un solo tipo de átomos; es decir, por átomos que tienen el mismo número atómico.
Hemos vistos que si una sustancia pura no puede descomponerse en otras por procedimientos químicos es un elemento. Esto es debido a que los elementos están formados por un solo tipo de átomos; es decir, por átomos que tienen el mismo número atómico.
En cambio, los compuestos son sustancias puras que se pueden descomponer en otras sustancias, porque están formados por más de un tipo de átomos.
El agua es un compuesto formado por los elementos químicos hidrógeno y oxígeno; la sal de cocina es un compuesto químico llamado cloruro de sodio, formado por los elementos cloro y sodio; el papel de aluminio y un anillo de oro, están formados, respectivamente, por los elementos aluminio y oro.
Importante
- Elemento. Sustancia pura que está formada por un sólo tipo de átomos.
- Compuesto. Sustancia pura que está formada por más de un tipo de átomos.
AV - Actividad de Espacios en Blanco
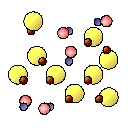
A continuación se representan cuatro cajas que contienen elementos y compuestos. Indica la letra que se corresponde con cada caja.
 |
 |
 |
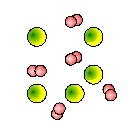 |
| Caja A |
Caja B |
Caja C |
Caja D |
COMPOSICIÓN QUÍMICA DEFINIDA
 |
| Imagen de J. Walker en Wikimedia. CC |
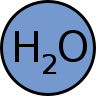
Las sustancias puras se representan mediante fórmulas, que indican la proporción entre los átomos de los elementos que las componen.
La composición de una sustancia pura es siempre la misma, independientemente del modo en que se haya preparado o de su lugar de procedencia. Esto es lo mismo que decir que las sustancias puras tienen una fórmula definida e invariable.
En el agua hay el doble de átomos de hidrógeno que de oxígeno, independientemente de que la obtengamos en el laboratorio por cualquier procedimiento o de que se encuentre en el mar, en un ser vivo o en un planeta extrasolar. Por eso, la fórmula del agua es H2O.
PROPIEDADES CARACTERÍSTICAS
La densidad, el punto de fusión y el punto de ebullición son propiedades que se utilizan para identificar una sustancia pura en el laboratorio, ya que cada sustancia presenta unos valores concretos para estas magnitudes.