1. Cómo se encuentra la materia en la naturaleza
Pre-conocimiento
 |
| Iceberg en Flickr. Licencia CC |
¿Sabes cuál es la sustancia más abundante que se observa en la fotografía?, ¿el hielo?, ¿el agua?, ¿acaso el vapor de agua?
Muy buena pregunta, y seguro que has dado la respuesta correcta pues, como sabes, el hielo es agua sólida y también hay agua en estado gaseoso en la atmósfera.
Pues es muy difícil encontrar una sustancia que esté, de forma natural, en los tres estados de agregación. A las temperaturas que nosotros vivimos (digamos que entre -10ºC y 40ºC), la mayoría de las sustancias o están en estado sólido, o en estado líquido, o en estado gaseoso... salvo el agua, claro, la sustancia más abundante en nuestro planeta.
En realidad, nada es sólido, líquido o gaseoso. Como el agua, todas las sustancias pueden estar en estado sólido, líquido o gaseoso... según la temperatura a la que se encuentren.
Como ya sabes, la materia la podemos encontrar en tres estados de agregación: sólido, líquido y gaseoso.
Las características de cada uno de los estados de agregación se pueden explicar basándonos en la interacción entre las partículas que los constituyen:
| En los gases apenas hay fuerzas entre las partículas y por eso éstas se mueven libremente. | En los líquidos las fuerzas entre las partículas son más intensas que en los gases, por eso se mantienen unidas, pero conservan una gran libertad de movimiento. | En los sólidos, las fuerzas entre las partículas son muy intensas, tanto, que prácticamente no pueden moverse, y tan solo vibran. |
Pre-conocimiento
 |
¿Sabías que el plasma es el cuarto estado de agregación de la materia?
Cuando un gas se calienta hasta una temperatura muy elevada los electrones pueden escapar de sus órbitas alrededor del núcleo del átomo. Cuando los electrones ya no están atrapados en sus órbitas alrededor del núcleo, tenemos el estado de plasma. Esto es cuando un gas se convierte en un montón de electrones que se han escapado de la fuerza del núcleo, y los iones que están cargados positivamente, porque han perdido uno o más electrones.
Si bien en nuestro planeta es un estado poco frecuente, la mayoría de la materia en el Universo se encuentra en el estado de plasma. Esto es porque las estrellas, que son tan calientes que sólo pueden existir en estado de plasma, forman una gran parte de la materia del Universo.
Actividad
 |
|
Imagen de dominio público
|
- Lo primero depende del tipo de partículas de las que esté hecho el cuerpo, es decir, de la sustancia concreta de que se trate.
- Lo segundo depende de la temperatura a la que esté.
| Calentamiento del agua en educaplus.org. Licencia CC |
Actividad
 |
| Imagen de dominio público |
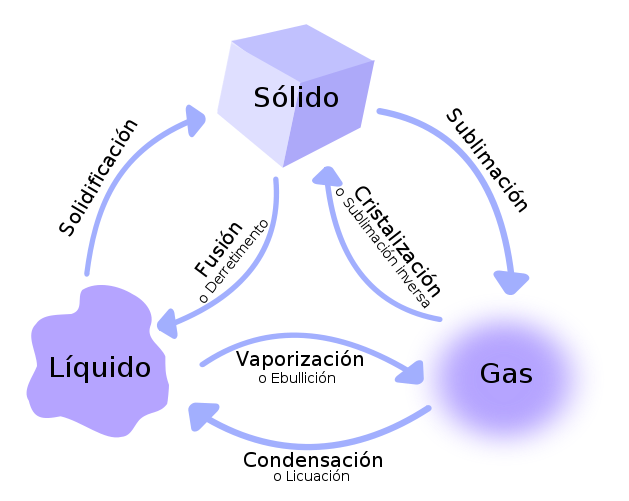
- Punto de fusión a la temperatura a la que ocurre el paso de sólido a líquido.
- punto de ebullición a la temperatura a la que el líquido pasa a gas.
AV - Reflexión
 En la gráfica se representa la variación de la temperatura de una sustancia con el tiempo. Responde a las siguientes preguntas:
En la gráfica se representa la variación de la temperatura de una sustancia con el tiempo. Responde a las siguientes preguntas:
a) ¿Es una gráfica de enfriamiento o de calentamiento? ¿Por qué?
b) ¿Cuál es la temperatura de fusión?
c) ¿Cuál es la temperatura de ebullición?
d) ¿En qué estado de agregación se encuentra a 25ºC?
e) ¿Cuál es su estado de agregación inicial?
Pre-conocimiento
Muchas veces el lenguaje nos confunde si no sabemos entenderlo bien. ¿Es lo mismo decir "el agua se evapora a 100ºC" que decir "el agua hierve a 100ºC"? ¿Qué crees que es más correcto?
 |
|
Evaporación
|
Como sabes, el agua que forma las nubes se evapora desde el mar, los ríos, los lagos,... ¿acaso el mar, los ríos, los lagos están a 100ºC? Evidentemente no. El agua se evapora a cualquier temperatura, pero sólo hierve (ebulle) a 100ºC, cuando está a su temperatura de ebullición.
¿Y cómo es eso? La temperatura está relacionada con la velocidad media de las moléculas; a una temperatura dada, no todas las moléculas se mueven igual de deprisa, las hay más lentas que la media y las hay más rápidas que la media. Siempre habrá alguna molécula "listilla" de la superficie de un líquido, que corra lo suficiente como para poder escapar de sus vecinas y pasar a ser una molécula de gas. Por eso, los líquidos se evaporan a cualquier temperatura.
Debido a esto, para evitar confusiones, llamamos evaporación al paso de agua líquido a agua gas que se produce a cualquier temperatura en la superficie del líquido, y ebullición, al cambio de estado que se produce en cualquier zona del agua a temperatura constante (100ºC, si la presión es 1 atmósfera).
De manera general, llamamos vaporización al cambio de estado de líquido a gas, por tanto, hay dos tipos de vaporización, la evaporación y la ebullición.
También de la superficie de los sólidos "se escapan" moléculas y pasan a ser moléculas de gas. Piensa si no cómo puede ser que olamos un sólido o que la bola de alcanfor (naftalina) que ponemos en el armario "desaparezca" al cabo de cierto tiempo.