6. Propiedades coligativas
Las propiedades de las disoluciones difieren en general de las del disolvente o del soluto por separado.
Se observan cambios en ciertas propiedades como son la densidad, la tensión superficial, etc. que dependen de la naturaleza de los componentes de la disolución.
Sin embargo hay otras propiedades que no dependen de la naturaleza de soluto y disolvente, sino de la concentración de la disolución, es decir, de la cantidad de sustancia disuelta. Estas son las llamadas propiedades coligativas y son el punto de fusión, el punto de ebullición, la presión osmótica y la presión de vapor.
DISMINUCIÓN DE LA PRESIÓN DE VAPOR
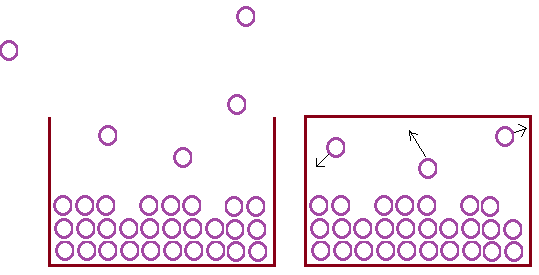
Los líquidos experimentan un proceso, la evaporación, que les permite pasar al estado vapor. Si este líquido está en un recipiente cerrado esas partículas en estado gaseoso no escapan a la atmósfera sino que se acumulan en el espacio encima del líquido, produciendo una presión, es la conocida como presión de vapor.
 |
| Imagen de CharoSaa en Wikimedia Commons. CC |
Lo que sucede es que se establece un equilibrio dinámico entre la fase líquida y la fase gaseosa (la velocidad de evaporación es igual a la de condensación de las partículas).
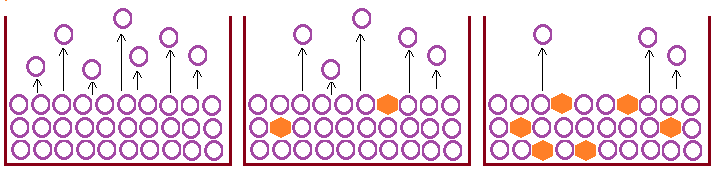
La presión de vapor no depende de la cantidad de líquido que tengamos. Sin embargo, si se añade un soluto a este líquido sí variará su presión de vapor, esta variación dependerá de la cantidad de soluto añadido.
Se cumple que la presión de vapor de un disolvente desciende cuando añadimos un soluto, de forma que cuanto más soluto añadamos, menor será la presión de vapor.
 |
| Imagen de CharoSaa en Wikimedia Commons. CC |
DESCENSO CRIOSCÓPICO
El punto de congelación (temperatura a la que una sustancia cambia de estado líquido a sólido) de las disoluciones acuosas es menor que el del agua.
Realiza la siguiente actividad en tu casa: pon agua del grifo en dos vasos hasta la mitad; a uno de ellos le añades sal y agitas hasta que se disuelva. Colócalos en un congelador y observa cuál se hiela antes o si se hielan ambos (dependerá de la temperatura mínima que alcance el congelador). Observarás que se congela antes el agua sin sal. Esto es porque las disoluciones diluidas congelan a temperaturas inferiores a las del disolvente puro. En otras palabras: desciende el punto de congelación.
Esta disminución es directamente proporcional a la molalidad de la disolución:
\[\Delta T_{C}=K_{C}\cdot m\]
donde
ΔTc= Temperatura congelación del disolvente - Temperatura congelación de la disolución
m= molalidad de la disolución (recuerda: m=moles soluto/masa disolvente en kg)
Kc= constante crioscópica del disolvente (característica de cada disolvente)
Este hecho tiene una aplicación práctica muy conocida: en invierno se echa sal en las carreteras para evitar que se formen capas de hielo. Con el mismo fin, los anticongelantes de los circuitos de refrigeración de los coches tienen etilenglicol (un tipo de alcohol) disuelto en agua.
Ejercicio Resuelto
Determina la temperatura a la cual congela una disolución que contiene 18 gramos de glucosa (C6H12O6) en 40 gramos de agua.
Dato: Constante crioscópica del agua: 1,86 ºC·kg·mol-1
Elevación ebulloscópica
A la temperatura de ebullición se cumple que la presión de vapor iguala a la presión atmosférica. Es por ello que esta propiedad coligativa está íntimamente relacionada con la disminución de la presión de vapor. Cualquier descenso de esta provocará un aumento del punto de ebullición de la disolución frente al disolvente puro. Este efecto depende directamente de la cantidad de soluto, cumpliéndose la siguiente expresión:
\[\Delta T_{e}=K_{e}\cdot m\]
donde
ΔTe= Temperatura ebullición de la disolución - Temperatura ebullición del disolvente
m= molalidad de la disolución
Ke= constante ebulloscópica del disolvente
Una prueba de esta propiedad se manifiesta al añadir sal al agua que calentamos al cocinar: el agua comienza a hervir por encima de 100 ºC (el punto de ebullición del agua pura), y por ello tardará más tiempo en hervir que si no hubiésemos añadido la sal estando el agua hirviendo, requiere entonces más temperatura para hervir.
Presión osmótica
 |
| Imagen de OpenStax en Wikimedia. CC |
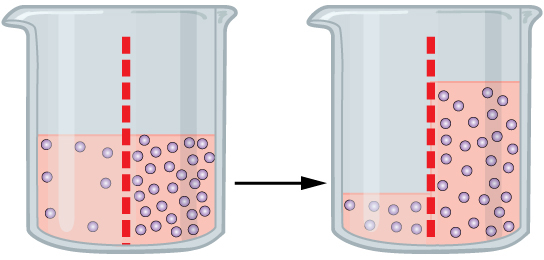
La ósmosis es el proceso por el que un disolvente se difunde a través de una membrana semipermeable.
Esto sucede cuando a los dos lados de la membrana hay concentraciones distintas de una disolución. El disolvente (no el soluto) pasa a través de la membrana desde la disolución más diluida a la más concentrada, de forma que se igualen las concentraciones a los dos lados de la membrana.
La presión osmótica es la presión necesaria para detener el paso de disolvente a través de la membrana semipermeable que separa las disoluciones de distinta composición.
Para saber más
El monóxido de carbono
 |
| Imagen de CNICE, uso educativo |
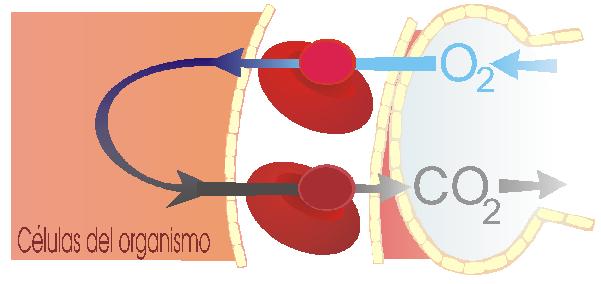
El oxígeno se disuelve en la sangre, sobre todo al unirse a la hemoglobina, y así se transporta desde los pulmones a las células que lo necesitan para los procesos de obtención de energía. En esos procesos se libera CO2, que es expulsado a la atmósfera desde los pulmones.
Sin embargo, hay un gas que interacciona con la hemoglobina con más facilidad que el propio oxígeno, y que al ocupar su lugar impide que llegue a las células la cantidad de oxígeno necesaria: es el monóxido de carbono, CO.
Se trata de un gas que se produce en lugares donde hay combustiones con poco oxígeno. Cada vez se forma más CO, que sustituye al oxígeno en la sangre y el ritmo vital va decayendo hasta que se produce el fallecimiento (se le llama la muerte dulce).
Todos los años se produce en España un apreciable número de accidentes de este tipo, con resultado de muerte (por mala combustión en calderas de calefacción, estufas de butano, braseros,...).