Descripción de la tarea

Una disolución (o solución) es una mezcla de dos o más componentes, perfectamente homogénea, de manera que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas). El soluto (o solutos) es el componente que se encuentra en menor cantidad y es el que se disuelve, mientras que el disolvente es el componente que se encuentra en mayor cantidad y en el que se disuelve el soluto.

Imagina que nos encontramos en un laboratorio con 6 disoluciones y un sólido, con ellos vamos a trabajar.
Pincha en la siguiente imagen, te lleva a una animación de la que extraerás los datos que necesitas para trabajar:
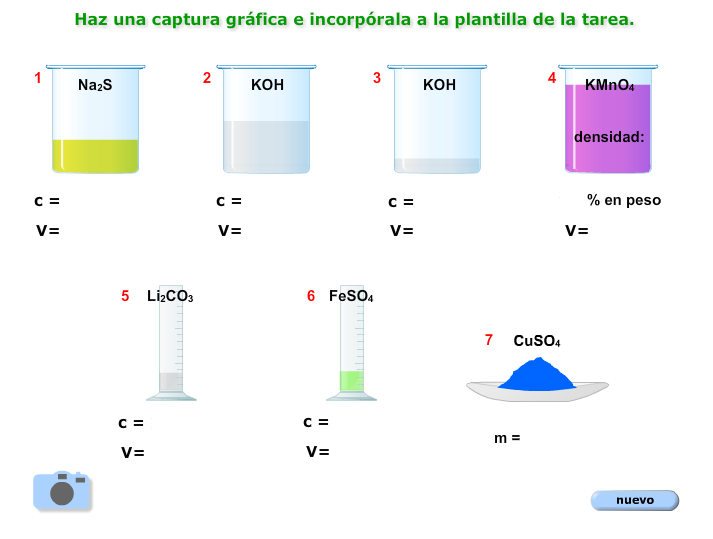 |
1.- Realiza todos los cálculos necesarios para poder completar la siguiente tabla (deja indicados todos los cálculos en el documento):
| sustancia | masa (g) |
cantidad (mol) |
|
| 1 | Na2S | ||
| 2 | KOH | ||
| 3 | KOH | ||
| 4 | KMnO4 | ||
| 5 | Li2CO3 | ||
| 6 | FeSO4 | ||
| 7 | CuSO4 |
2.- Si a la disolución de Na2S le añadimos agua hasta completar un volumen de 2,7 L, ¿cuál sería el valor de la nueva concentración? Exprésalo en mol/L y g/L.
3.- Indica de forma razonada cuál de las dos disoluciones de KOH está más concentrada. ¿Cómo podrías preparar la disolución más diluida a partir de la más concentrada? Realiza los cálculos correspondientes.
4.- Si se mezclan estas dos disoluciones de KOH, ¿cuál sería la concentración (en mol/l) de la disolución resultante?
5.- Imagina que, a partir del CuSO4, se quieren preparar 750 mL de una disolución de concentración 2.2 mol/L. ¿Tendrías suficiente con la masa de CuSO4 pesada? Describe el proceso completo de preparación indicando el material de laboratorio que emplearías.
A continuación te proponemos que estudies las propiedades coligativas de las disoluciones trabajando con el siguiente simulador:
| Animación de Charo Saá en Geogebratube |
En primer lugar nos centraremos en el aumento del punto de ebullición que experimenta un disolvente al añadirle un soluto no volátil. Para ello, en la simulación anterior, debes señalar primero la opción "hot", que significará que el sistema se va a poner a calentar. Elige uno de los disolventes ("solvents") y la masa del mismo (cuyo valor varía entre 100 y 500 g). A continuación, elige una de las sustancias que actuarán como soluto ("Solutes").
6.- Registra, en una tabla, el valor de la temperatura de ebullición del disolvente elegido al añadirle 5 cantidades diferentes de soluto. Representa dichos datos en una gráfica. ¿Qué conclusión puedes sacar a partir de la observación de dicha gráfica?
7.- Calcula los valores de la molalidad de cada una de las cinco disoluciones con las que has trabajado. En base a dichos datos y a los datos de temperatura medidos, obtén el valor de la constante ebulloscópica (Kb) para cada uno de los casos. ¿A qué conclusión puedes llegar, comparando los datos obtenidos con el valor real de Kb?
A continuación estudiaremos el descenso crioscópico. Para ello, tendremos que poner el sistema en frío ("Cold").
8.- Toma el mismo disolvente y el mismo soluto que en la experiencia anterior y en las mismas cantidades. Siguiendo el mismo protocolo que antes, calcula el valor de la constante crioscópica (Kf) y compáralo con el valor real. Obtén tus conclusiones al respecto.
9.- Plantea dos situaciones que se puedan dar en tu entorno y que pongan de manifiesto estas propiedades coligativas de las disoluciones.
![]()
En esta tarea te familiarizarás con las disoluciones y trabajarás conceptos que volverán a aparecer en la tarea global.