1.2 Números de oxidación
Curiosidad
 ¿Valencia, o número de oxidación?.
¿Valencia, o número de oxidación?.
La valencia indica el número de enlaces o uniones iónicas que puede formar en un momento dado un átomo. Es un número que siempre es positivo.
Es un término en desuso, que se ha sustituido por el número de oxidación (o estado de oxidación), que es un término más amplio, pues aparte de indicarnos las posibles uniones de un átomo, también nos dice si el átomo gana o pierde electrones. Así, mientras que el término valencia es un número entero sin signo, el número de oxidación tiene signo y puede ser positivo o negativo.
Actividad
La nomenclatura sistemática, intenta (y en cada actualización lo consigue un poquito más) que no sea necesario aprender y memorizar todos los números de oxidación posibles para los elementos, pues a partir del nombre sistemático se obtiene directamente la fórmula y al contrario. Pero cuando se utiliza la nomenclatura funcional, sí es necesario saber el número de oxidación que utiliza cada elemento.
En la imagen que hay a continuación puedes ver una tabla periódica con los números de oxidación más frecuentes de los elementos, puedes hacer clic sobre ella y obtendrás un documento que puedes imprimir y tener a mano cuando trabajes la formulación.
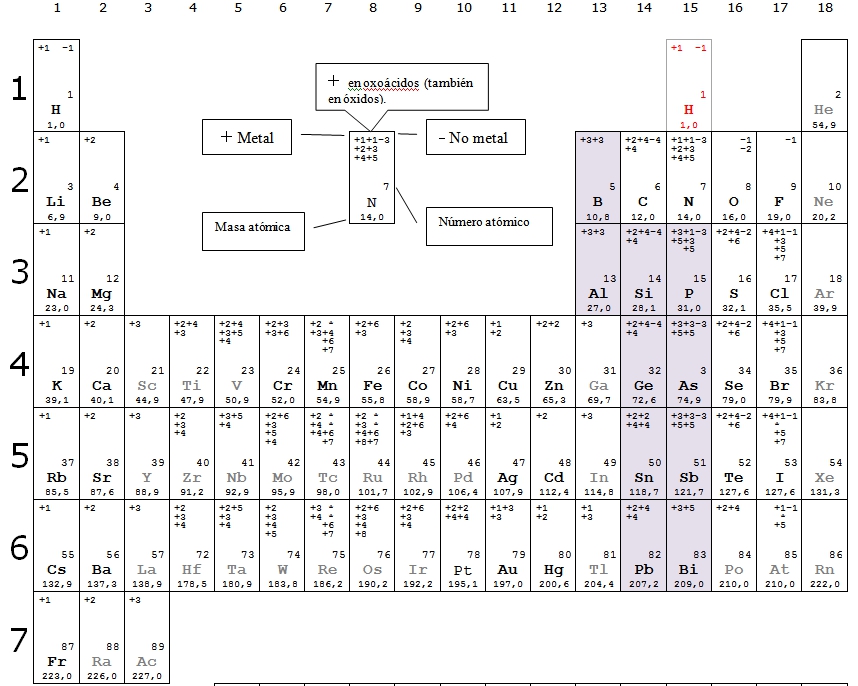 |
| Imagen de elaboración propia |
Como ves, son muchos los números de oxidación posibles, tantos que es muy difícil, casi imposible, memorizarlos todos, así que no te esfuerces inicialmente en aprenderlos, simplemente utiliza la tabla y verás como vas aprendiendo poco a poco los más importantes.
Observarás que hay en la tabla elementos que resaltan sobre los demás, su símbolo está escrito en negrita, pues sólo esos elementos utilizaremos para practicar, por tanto, al final, sólo de esos tienes que conocer sus números de oxidación.
También puedes observar unos cuantos elementos que se encuentran sombreados (B, Al, Si, Ge, Sn, Pb, P, As, Sb y Bi). Estos elementos son un poquito especiales al formar oxoácidos y por eso, para que no se te olvide al formular los oxoácidos, están resaltados.
Como ves, los números de oxidación se encuentran en la tabla en tres columnas:
- Si el elemento actúa como metal, utiliza los números de oxidación positivos de la izquierda.
- Si el elemento actúa como no metal, utiliza el número negativo de la columna de la derecha.
- La columna central la utilizan los elementos para formar los oxoácidos y derivados y también para los óxidos (los óxidos se forman pues, con cualquiera de las valencias positivas que tiene el elemento, tanto las centrales como las de la izquierda).
Así pues, los números de oxidación de la columna central son para formar oxoácidos y para éstos se utiliza el nombre funcional, para el que es necesario conocer el número de oxidación. Pues ya sabes, para esos números de oxidación centrales es para los que tienes que prestar más atención, tienes que saberlos todos, los de los elementos con el símbolo en negrita claro.
Actividad
Un mismo elemento puede comportarse de diferentes formas para unirse a otros átomos:
- Con los números de oxidación positivos de la izquierda, si los tiene, actúa como metal, cediendo, o compartiendo con otro átomo más electronegativo los electrones indicados por el número de oxidación.
- Cuanto tiene un número de oxidación negativo a la derecha se comporta como no metal, el átomo acepta o comparte con otro átomo menos electronegativo los electrones indicados por el número de oxidación.
- Los números de oxidación positivos centrales, cuando los tiene, son exclusivamente para uniones con el oxígeno, formando oxoácidos (y también óxidos).
Pre-conocimiento

Si observas detenidamente la tabla periódica con los números de oxidación apreciarás algunas regularidades como las siguientes:
- Los metales tienen sólo números de oxidación positivos.
- Los no metales pueden tener números positivos y negativos.
- Las tres primeras columnas tienen números de oxidación, +1, +2, +3, respectivamente, coincidiendo con el número de grupo.
- Las columnas 4, 5, 6 y 7 tienen varios números, pero como mínimo tienen el número del grupo +4, +5, +6 y +7.
- Observa que los elementos del periodo 4 y los grupos 8, 9 y 10, tienen los números de oxidación +2 y +3.
- El grupo 11 tiene como mínimo +1, el 12 como mínimo +2, el 13 como mínimo +3,... y así hasta el grupo 17.
- También pueden recordarse otros número de oxidación por parecer una serie matemática. Por ejemplo los números de oxidación para formar oxoácidos de los elementos del grupo 17 son +1, +3, +5 y +7. y para obtener las de los grupos anteriores, le vamos restando una unidad, así los del grupo 16 serán +4 y +6, los del grupo 15 serán +3 y +5, los del grupo 14, +4 y los del grupo 13, +3. Hay algunas excepciones a esta regla general, que poco a poco irás aprendiendo, pero para empezar no está nada mal.
- Tan solo tienen números negativos, los elementos de los grupos del 14 al 17 y el número de oxidación puede obtenerse restando 18 al número de grupo correspondiente, así el grupo 14 tiene (14 - 18 =) -4, el grupo 15 tiene (15 - 18 =) -3, el grupo 14 tiene -2 y el grupo 17 tiene -1.
- Si consultas diferentes tablas periódicas con los números de oxidación, observarás algunas diferencias entre ellas, esto se debe a que suelen omitirse algunos números de oxidación menos frecuentes o importantes. ¿por qué no son importantes? Porque las sustancias que contienen ese elemento con ese número de oxidación son escasos, se transforman rápidamente en otras sustancias, etc...
AV - Actividad de Espacios en Blanco
AV - Actividad de Espacios en Blanco
Ahora vas a construir una tabla resumen con los números de oxidación de los elementos más frecuentes. Se trata de que escribas los símbolos de los elementos que tienen el número de oxidación que se indica (escríbelos en el mismo orden que están en la tabla periódica).
Bueno ya has visto lo que son las fórmulas de las sustancias, y que cuando los átomos intervienen en una fórmula, utilizan un determinado número de electrones, para unirse bien intercambiando, bien compartiéndolos, pero ¿serías capaz de averiguar el estado de oxidación de un elemento cuando te dan la fórmula?. Por ejemplo, ves que en el Al(OH)3 el número de oxidación del aluminio es +3, en el H2SO4 el número de oxidación del azufre es +6. Si no te resulta fácil averiguarlo, puedes utilizar estas sencillas reglas para calcularlo.
- En las sustancias que son elementos, el número de oxidación de cero. por ejemplo: Cl2, S8, Al, C, tienen estado de oxidación 0.
- En los iones formados por un átomo, el número de oxidación coincide con la carga que tengan. Por ejemplo, en el Ca2+ el número de oxidación es +2, en el S2- el número de oxidación es -2, en el Au+ el número de oxidación es +1.
- El hidrógeno tiene estado de oxidación -1 cuando se une a los metales y +1 cuando se une a los no metales.
- El oxígeno tiene número de oxidación -2, salvo en los casos poco frecuentes de que forme peróxidos, en los que tiene -1.
- En una fórmula la suma de los números de oxidación de todos los elementos que intervienen es igual a la carga que tenga, cero si se trata de una sustancia neutra.
Por ejemplo, aplicando estas sencillas se puede calcular el número de oxidación es estos ejemplos:
- H3PO4 --> H(+1)3P(?)O(-2)4 --> +3 + ? + (-8) = 0 --> ? = +5. el número de oxidación del fósforo es +5.
- FeH2 --> Fe(?)H(-1)2 --> ? + (-2) = 0 --> ? = 2 --> El número de oxidación del hierro es +2.
- CO2 --> C(?)O(-2)2 --> ? + (-4) = 0 --> ? = +4 --> El número de oxidación del carbono es +4.
- NO3- --> N(?)O(-2)3- --> ? + (-6) = -1 --> ? = +5 --> El nitrógeno tiene número de oxidación +5.
- Cr2O72- --> Cr(?)2O(-2)72- --> 2(?) + (-14) = -2 --> ? = +6 --> El número de oxidación del cromo es +6.
Actividad
Para averiguar el número de oxidación de un elemento en una fórmula, has de tener en cuenta que la suma de todos los números de oxidación de todos los átomos es exactamente igual a la carga que tenga, o cero si es una sustancia neutra (sin carga eléctrica).