1.1 Fórmulas químicas
Pre-conocimiento
 |
| Imagen de dominio público |
Como sabes, los símbolos químicos son las abreviaturas que se utilizan para identificar los elementos químicos en lugar de sus nombres completos. Algunos elementos frecuentes y sus símbolos son: carbono, C; oxígeno, O; nitrógeno, N; hidrógeno, H; cloro, Cl; azufre, S; magnesio, Mg; aluminio, Al; cobre, Cu; argón, Ar; oro, Au; hierro, Fe; plata, Ag, platino, Pt.
Como ves, la primera letra del símbolo se escribe en mayúscula y la segunda, si la hay, en minúscula. Además, si el símbolo tiene dos letras no se lee como sílaba, se leen las dos letras, por ejemplo el hierro, Fe, no se lee "fe", se lee "efe e".
¿Sabes de dónde proceden esas abreviaturas tan raras para algunos elementos?, por ejemplo del oro Au, del fósforo P, etc... Pues proceden del latín, del inglés, del alemán..., por ejemplo el oro procede del término latino "aurum", que significa brillante amanecer. Si quieres conocer la procedencia del nombre y/o el símbolo de los elementos, puedes consultar este enlace.
| H2O |
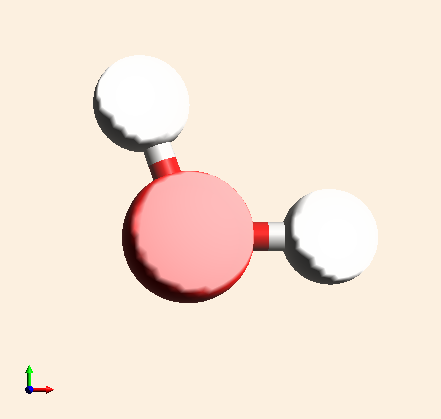 |
Representa una molécula de agua. Está formada por la unión de dos átomos de hidrógeno y uno de oxígeno |
| NH3 | 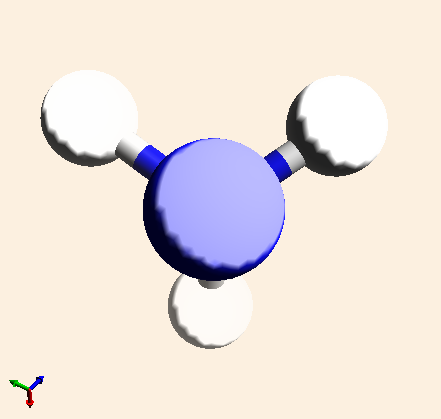 |
Representa una molécula de amoniaco. Está formada por la unión de un átomo de nitrógeno y tres de hidrógeno. |
| CH4 | 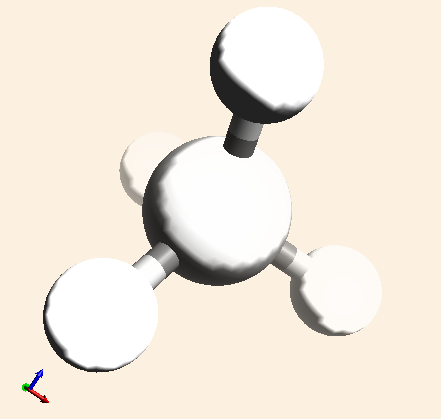 |
Representa una molécula de metano. Está formada por un átomo de carbono y cuatro átomos de hidrógeno. |
| Imágenes de elaboración propia |
||
Una fórmula es, en una primera aproximación, la representación abreviada de una molécula y dice qué átomos la integran y cuántos se combinan.
En la tabla de la derecha tienes tres ejemplos que te ilustran las fórmulas del agua, el amoniaco y el metano.
Como ya has visto en unidades anteriores, conociendo la fórmula de una sustancia, podemos averiguar fácilmente:
- La masa molar de la sustancia (sumando las masas atómicas relativas de los átomos que intervienen en la fórmula y expresándola en gramos). Esto lo estudiaste en la unidad 1, "Naturaleza y estructura de la materia". Y también la composición centesimal de la sustancia, como ya estudiaste también en la unidad 1.
- El tipo de enlace existente entre los átomos y por tanto las propiedades de la sustancia, (iónico si enlaza átomos metálicos y no metálicos, covalente si enlaza átomos no metálicos y metálico si los átomos enlazados son metálicos). Esto lo has estudiado en la unidad 2, "El enlace químico".
Pero como sabes, tan solo las sustancias moleculares están formadas por moléculas. En las demás sustancias, ya sean iónicas, covalentes o metálicas, no es correcto hablar de moléculas. En estos casos la fórmula, sólo nos indica la proporción en que se combinan los átomos para dar lugar a la sustancia, bien sean iones, en las sustancias iónicas o metálicas, o átomos en las sustancias covalentes.
Para indicar la fórmula de una determinada sustancia, se escriben juntos los símbolos de los elementos que la constituyen con un subíndice que indica el número de átomos de cada elemento. Por ejemplo Fe2O3 es una sustancia que contiene hierro y oxígeno en la proporción 2 átomos de hierro por cada 3 átomos de oxígeno. El número 1 siempre se omite, por tanto, cuando un elemento aparece sin número, indica que hay un átomo de ese elemento.
Actividad
La fórmula de una sustancia indica la proporción en que se combinan los átomos de los elementos que la constituyen. Pero si se trata de una sustancia molecular, la fórmula dice el número de átomos de cada clase que contiene la molécula.
La fórmula es una secuencia de símbolos de elementos, con subíndices para indicar el número de átomos. El numero 1 siempre se omite.
AV - Reflexión
El trihidruro de boro o borano tiene la fórmula: BH3
¿Qué significado tiene esa fórmula?.
Pero en las fórmulas pueden aparecer también otros símbolos, los más comunes son los siguientes:
|
Paréntesis
() |
para indicar que un número afecta a más de un átomo. |
Ca(OH)2 |
El hidróxido de calcio tiene un átomo de calcio por cada dos átomos de oxígeno y dos átomos de hidrógeno. Al tener un paréntesis, el 2 afecta tanto al oxígeno como al hidrógeno. |
| Fe2(SO4)3 | El sulfato de hierro(III) es una sal constituida por la combinación de iones hierro(3+) e iones sulfato, en la proporción 2:3, es decir, hay dos iones Fe3+ por cada tres iones SO42-. El paréntesis hace que el 3 afecte tanto al azufre como al oxígeno. En esta sustancia hay dos átomos de hierro por cada tres átomos de azufre y por cada doce átomos de oxígeno. | ||
|
Signo en
+ / - |
para indicar la carga positiva o negativa de un ión. se escribe primero el número y después el signo. Recuerda que el número 1 siempre se omite. | SO42- | El ion sulfato tiene cuatro átomos de oxígeno por cada átomo de azufre y además el conjunto tiene dos cargas negativas. |
| NH4+ | El ion amonio tiene un átomo de nitrógeno, cuatro átomos de hidrógeno y una carga positiva (por faltarle un electrón). | ||
|
Signo en
el nombre (+/-) |
para indicar la carga eléctrica de un ion, se escriben inmediatamente después del nombre entre paréntesis el número y el signo de la carga. El número 1 nunca se omite. |
NO3- | El trioxidonitrato(1-) está constituido por un átono de nitrógeno y tres de oxígeno, teniendo además una carga negativa. |
| Cr2O72- | El heptaoxidodicromato(2-) está formado por dos átomos de cromo y siete de oxígeno y tiene dos cargas negativas. | ||
|
Números
romanos
|
para indicar el número de oxidación de un átomo, se escriben inmediatamente después del nombre del elemento. |
FeO42- | En el tetraoxidoferrato(VI), el número de oxidación del hierro es +6, por eso se indica entre paréntesis y en números romanos. |
| CrI3 | En el yoduro de cromo(III), el número de oxidación del cromo es +3, por eso se indica en números romanos. | ||
|
Estado de (s/l/g/ac) |
cuando es necesario indicar el estado de agregación de la sustancia, se escriben inmediatamente después del nombre de la sustancia, entre paréntesis, la abreviatura del estado de agregación:
|
CO2(g) | El dióxido de carbono está constituido por moléculas con un átomo de carbono y dos de oxígeno. (g) indica que se encuentra en estado gaseoso. |
| H2O(l) | El agua está constituida por moléculas con dos átomos de hidrógeno y un átomo de oxígeno, (l) significa que se encuentra en estado líquido. |
||
| NaCl(s) | En el cloruro de sodio se combinan el sodio y el cloro en la relación 1:1. (s) indica que se encuentra en estado sólido. | ||
| MnO4-(aq) | El ión permanganato está constituido por un átomo de manganeso y cuatro de oxígeno y tiene una carga negativa. (ac) indica que se encuentra en disolución acuosa. |
AV - Pregunta de Elección Múltiple
Solution
Solution
Solution
Solution
AV - Reflexión
Observa la siguiente reacción química en la que el óxido de calcio reacciona con el agua formando dihidróxido de calcio. ¿en que estado de agregación se encuentra cada sustancia?.
CaO(s) + H2O(l) → Ca(OH)2(ac)
Ya has visto que la fórmula de una sustancia es una secuencia de símbolos, ¿pero en qué orden aparecen los elementos?. El orden en que se escriben los elementos depende del valor de su electronegatividad, pero no te asustes, es muy fácil, pues siguen el orden de la tabla periódica. El sentido de la flecha de la imagen de abajo indica el orden decreciente de electronegatividad, es decir, la flecha va del elemento más electronegativo, el flúor (F), hasta el menos electronegativo, el radón (Rn).
Pues ese es el orden en que se escriben los símbolos en la fórmula, el más electronegativo, se escribe a la derecha y el menos electronegativo a la izquierda, es decir, se escribe primero el más metálico y luego el menos metálico. Cuando en la fórmula hay más de dos elementos, el orden se establece de una manera particular que verás más adelante.
 |
| IUPAC. Nomenclatura de Química Inorgánica.Recomendaciones de 2005. |
Como ves, el orden que se sigue es el mismo de la tabla periódica, tan solo hay dos excepciones, el hidrógeno, que hay que colocarlo justo a la derecha del nitrógeno y los gases nobles, que aparecen en la primera columna de la izquierda en vez de en su lugar habitual. Observa que el sentido de la flecha indica el orden decreciente de electronegatividad.
Actividad
En una fórmula, se escribe el último (a la derecha) el elemento que aparece primero en la secuencia de elementos, es decir, el que se encuentra más a la derecha en la tabla periódica y de estar en el mismo grupo, el que está más arriba. Es decir, en la fórmula se escribe primero el metal y luego el no metal.
Pero cuidado con el hidrógeno, que no se encuentra en su lugar habitual, lo colocamos a la derecha del nitrógeno.