2.1.1. El agua, la molécula de la vida
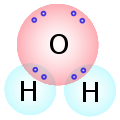 |
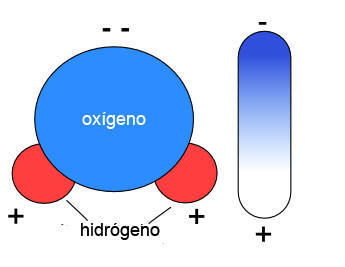
Este tipo de enlace implica que el hidrógeno y el oxígeno van a compartir electrones. Pero el oxígeno atrae hacia sí el par de electrones de enlace, por lo que queda con carga negativa, en tanto que los átomos de hidrógeno quedan con carga positiva. Por esta razón la molécula de agua, aunque es neutra, no posee carga, queda con una parte positiva (donde se localizan los átomos de hidrógeno) y otra negativa (donde se encuentra el oxígeno). Decimos que el agua es dipolar. |
 |
| Apostoloff Creative C. | Fisheye. Cretive Commons |
|
Así, entre moléculas de agua muy próximas se establece una atracción (entre la parte positiva de una molécula y la negativa de otra) que se conoce como enlace de puente de hidrógeno. Son enlaces muy débiles, pero numerosos, que se forman y se rompen continuamente. La siguiente animación te ayudará a entender cómo se comportan las moléculas de agua: |
Importante
La bipolaridad de la molécula de agua y la existencia de enlaces de puente de hidrógeno, hacen que el agua posea una serie de propiedades físico químicas que le permiten realizar funciones imprescindibles para la vida.
|
Elevada fuerza de cohesión entre sus moléculas, debido a los enlaces de puente de hidrógeno, por lo que sus moléculas tienden a permanecer unidas y, por tanto, es lo que hace que el agua sea líquida a temperatura ambiente (moléculas parecidas son gases). Esta propiedad le permite dar volumen a las células y actuar como esqueleto hidrostático (mantener la forma) También explica que el agua tenga una elevada tensión superficial, es decir, que su superficie oponga una gran resistencia a romperse. Observa en la imagen de la izquierda, como un clip de acero es capaz de mantenerse sobre la superficie del agua sin hundirse. |
 |
| Noodle Snacks (C.C.) |
Curiosidad
 |
Habrás observado cómo en los remansos de un río muchos insectos, más densos que el agua, se pueden desplazar perfectamente por su superficie. Aquí tenemos otra prueba de la alta tensión superficial del agua. |
| Fred Bolger. Creative Commons |
Elevada fuerza de adhesión, es decir, para unirse a otras superficies. ¡El agua moja!
Curiosidad
 |
La elevada fuerza de cohesión y adhesión del agua permite explicar el fenómeno de la capilaridad: el agua es capaz de ascender a través de un tubo muy fino en contra de la acción de la gravedad. Esto contribuye a facilitar la ascensión de la savia bruta en las plantas. |
 |
| Pajs. Creative Commons | MesserWodland |
Elevado calor específico, ya que el agua necesita una gran cantidad de calor para que su temperatura se eleve, porque hay que romper los enlaces de puente de hidrógeno que, aunque débiles, son muy numerosos. Esto supone que el agua sea un amortiguador térmico, absorbe gran cantidad de calor con escasos cambios en la temperatura.
 |
Elevado calor de vaporización. El paso de estado líquido a vapor requiere una gran cantidad de de calor para romper los enlaces de puente de hidrógeno. Cuando el agua se evapora en la superficie de un ser vivo la energía que necesita la toma del organismo, que se refrigera. Cuando sudamos perdemos calor y nos refrigeramos
|
| Lucky B Creative Commons |
|
Gran poder disolvente. Por ser una molécula polar, el agua puede separar iones y moléculas polares, rodeándolos para impedir que se vuelvan a unir. Este fenómeno se conoce como disolución y facilita el transporte de sustancias disueltas y las reacciones químicas. |
 |
| Taxman. Creative Commons |
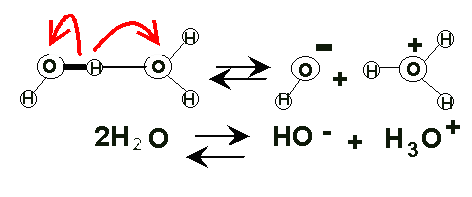 |
Bajo grado de ionización. En el agua líquida existe una pequeña cantidad de iones OH- y H3O+. En el agua pura, una molécula de cada diez millones está ionizada. A partir de este hecho se establece el concepto de pH, que nos indica la concentración de iones H3O+ en disolución. |
| Lourdes Luengo (Consejería de Educación) |
| Menor densidad en estado sólido. El hielo es menos denso que el agua líquida, el hielo flota. Esto permite que, cuando se hiela la superficie de mares y lagos, el interior permanezca líquido y la vida acuática continúe. |  |
| José Luis Castillo (CC 3.0) |
AV - Pregunta Verdadero-Falso
Sólo para repasar ideas importantes... Piensa y pincha...
Retroalimentación
Verdadero
Lo que indica la pregunta es verdad. Esos enlaces, débiles, permiten que las moléculas de agua estén más unidas de lo que estarían sin ellos. Por eso es un líquido, en vez de un gas. Y por eso tiene el montón de propiedades que tiene.
Retroalimentación
Verdadero
Lo que indica la pregunta es cierto. Se trata de enlaces que se producen por que un átomo tiene un electrón más tiempo del normal (o le falta). Eso hace que tenga una carga eléctrica, pero sólo temporal. Una carga parcial, vamos. Si tener un electrón todo el tiempo, si tener una carga eléctrica completa, sirve para formar enlaces débiles, tenerlo sólo un rato sirve para formar enlaces muy débiles.
Retroalimentación
Falso
Si se trata de enlaces débiles, no dura mucho, no. La propia agitación de los átomos, su propia vibración, hace que se rompan enseguida. Pero enseguida se vuelven a formar. ¿Eso los hace débiles? Piensa en el velcro. Cada unión es muy débil, pero el conjunto es muy fuerte.
AV - Pregunta Verdadero-Falso
Solo para comprobar algunas cosas... Piensa y pincha, pero primero piensa.
Retroalimentación
Verdadero
Lo que indica la pregunta es cierto. Las reacciones químicas suceden porque se rompen unos enlaces y se forman otros. Si ya los encuentras rotos, ¡pues trabajo que te ahorras y más fácil que resulta la reacción! :)
Retroalimentación
Falso
Lo que afirma la frase es falso, porque eso es la tensión superficial. La capilaridad es la unión de las moléculas de agua a la pared del recipiente en el que está. Es decir, su capacidad de mojar.
Retroalimentación
Verdadero
Lo que dice la frase es cierto. Y eso se debe a los puentes de hidrógeno. Romperlos cuesta energía. Si hace mucho calor el agua se evapora más y parte del calor se ha consumido en romper puentes de hidrógeno para evaporar moléculas de agua. Si hace frío, las moléculas de agua sueltas que hay en el aire se mueven menos, por lo que chocan más fácilmente. Y al formarse los puentes de hidrógeno se libera energía, que sube la temperatura.