3. Partículas subatómicas
Ya sabes que el núcleo del átomo está formado por protones. Parece lógico pensar que la masa del núcleo atómico debe coincidir con la suma de las masas de los protones que lo constituyen. Sin embargo esto no es así, medidas precisas de la masa de los núcleos realizadas con el espectrógrafo de masas indican que la masa de los núcleos es mayor que la esperada al sumar la masa de sus protones. La explicación podría estar en la existencia de otra partícula que acompañe a los protones en el interior del núcleo de los atómos. El propio Rutherford ya había planteado ante la Royal Society en 1920 que en el núcleo atómico, además de los protones, debía haber otras partículas sin carga eléctrica.
El hecho de no poseer carga esas supuestas partículas planteadas por Rutherford impidieron su reconocimiento y fue en 1932, cuando James Chadwick demostró la existencia de estas partículas a las que denominó neutrones y se pudo establecer que tiene una masa parecida a la del protón.
Conocida la existencia del neutrón, podrás encontrar clarificador la siguiente tabla que resume las partículas elementales principales constituyentes de un átomo:
| Partícula |
Carga (C)
|
Masa (kg)
|
| Electrón |
-1.6 10-19
|
9.1 10-31
|
| Protón |
1.6 10-19
|
1.6748 10-27 |
| Neutrón |
0
|
1.6725 10-27
|
Para que hagas memoria, aquí tendrás que echar mano de algunos conceptos de años anteriores.
- Al número de protones que hay en un núcleo atómico se le llama número atómico Z.
- A la suma del número de protones (Z) y neutrones (N) de un núcleo se le llama número másico A. Obviamente A=Z+N
Cuando queremos representar un núcleo concreto de un elemento de símbolo X lo hacemos de la siguiente forma: ![]()
El número atómico Z es un número muy importante porque identifica al elemento. Esto significa que, dado un elemento cualquiera del sistema periódico, podemos afirmar sin equivocación cuántos protones hay en el núcleo de cada uno de sus átomos. Sin embargo, no ocurre así con el número de neutrones, que puede variar de unos núcleos a otros del mismo elemento.
Esto hace que los átomos se puedan agrupar de forma más general según sea número atómico o su masa atómica. Las especies atómicas resultantes son más numerosas que los elementos y reciben el nombre de NÚCLIDOS o NUCLEIDOS. Lo siguiente es una forma de agrupar estos núclidos:
| NÚCLIDOS | CARACTERÍSTICAS | EJEMPLO |
| Isótopos | Igual número atómico y distinto número másico | |
| Isótonos |
Igual número de neutrones |
|
| Isóbaros | Igual número másico |
Objetivos
 |
|
| Imagen en Wikimedia Commons de pjhgwiki. CC0 |
Para nuestro propósito en este tema, basta con considerar sólo la existencia de protones y neutrones en el núcleo atómico, todo lo que necesitamos lo podemos explicar a partir de estas partículas.
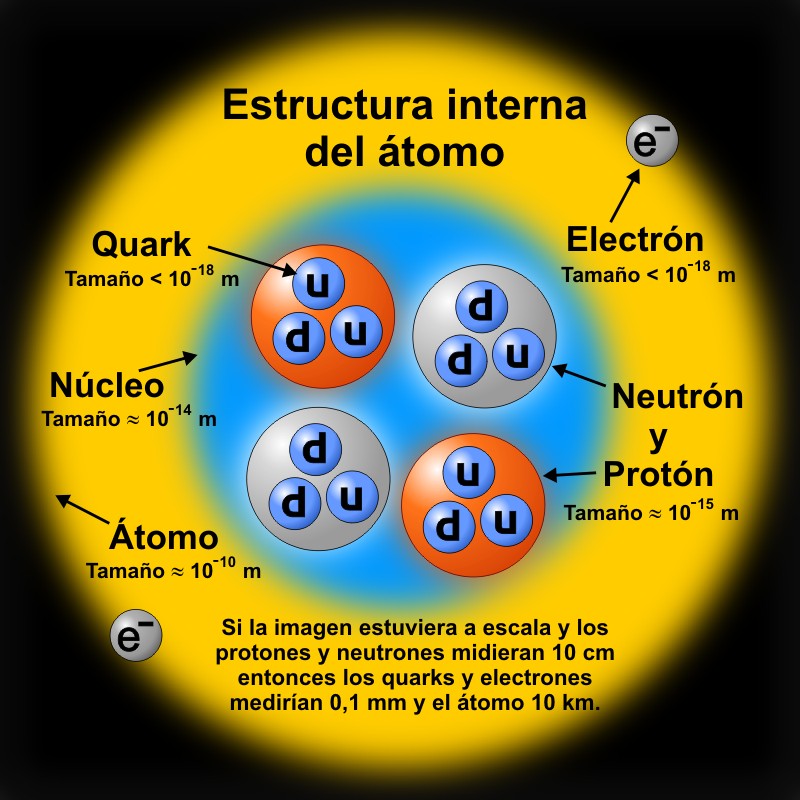
Sin embargo, hoy sabemos que el núcleo atómico es una estructura mucho más compleja. Para empezar protones y neutrones no son partículas elementales sino que están formados por tres quarks cada uno que, a su vez, pueden ser de dos tipos, up (u) y down (d). Observa la figura y verás la composición de cada uno. Existen, además, cuatro tipos de quark más: strange (s), charmed (c), bottom (b) y top (t).
Y esto sólo es el principio, en la actualidad se conocen cientos de partículas que se clasifican en dos grupos:
- Leptones: Son aquellas partículas que no se ven afectadas por la interacción nuclear fuerte, el electrón es un ejemplo.
- Hadrones: Se ven afectadas por la interacción fuerte. Pueden ser de dos tipos:
- Mesones: Formados por un quark y un antiquark.
- Bariones: Formados por un grupo de tres quarks como, por ejemplo, protones y neutrones.
Y por si esto fuera poco cada partícula tiene su antipartícula, que es otra con las mismas propiedades que la primera pero con carga eléctrica y momento angular opuestos.
Ya imaginarás que no podemos extendernos más. Como ves, la física nuclear constituye un mundo complejo y apasionante si decides profundizar en él.