4. Cálculo de la fórmula a partir de la composición centesimal
|
RECUERDA Ya sabes que los subíndices que están a la derecha de los símbolos de los elementos en la fórmula empírica de un compuesto, indican la proporción entre el número de átomos o entre el número de moles de los elementos que lo forman, ya que ambas coinciden. Por ejemplo, CaCO3 es la fórmula del carbonato de calcio e indica que por cada átomo de calcio, hay un átomo de carbono y tres átomos de oxígeno. Pero también indica que en cualquier muestra de dicho compuesto hay 1 mol de Ca y 1 mol de C por cada 3 moles de O. |
 |
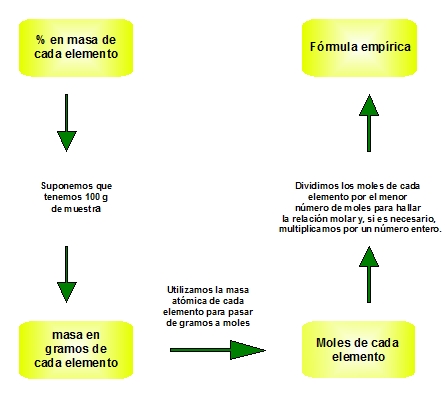 |
Entonces, para calcular la fórmula empírica de un compuesto del que conocemos el porcentaje en masa de los elementos que lo forman, nos bastaría con hallar la proporción entre el número de moles de los distintos elementos en una cantidad cualquiera del compuesto, por ejemplo, en 100 gramos (la fórmula tiene que ser la misma, independientemente de la masa de sustancia que tomemos), y expresarla en forma de números enteros y sencillos.
Lo entenderás mejor con un ejemplo:
Vamos a calcular la fórmula empírica de un compuesto cuya composición en masa es del 36% en aluminio y 64% en azufre:
- Si suponemos que tenemos 100 gramos del compuesto, los porcentajes en masa indicarán los gramos de cada elemento en esos 100 gramos. Habrá 36 g de Al y 64 g de S.
- Utilizando la masa atómica de cada elemento, podemos transformar su masa en número de moles. De esta manera hallamos la relación entre el número de moles de los distintos elementos, pero seguramente no estará expresada en forma de números enteros y sencillos:
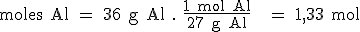
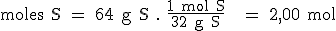
- Para expresar la relación anterior en forma de números enteros y sencillos, dividimos el número de moles de cada elemento entre el número de moles menor de todos ellos.
Relación de moles:
moles Al = 1,33 mol / 1,33 mol = 1
moles S = 2 mol / 1,33 mol = 1,5
- Es posible que, aún así, no se obtenga una relación de números enteros, y tengas que multiplicar por un número sencillo para conseguirlo. En el ejemplo, vemos que una relación de moles de 1 mol de Al por 1,5 moles de S, es lo mismo que decir que por cada 2 moles de Al hay 3 moles de S. Por tanto, tenemos que multiplicar ambas cantidades por 2:
Relación de moles:
moles Al = 1 x 2 = 2
moles S = 1,5 x 2 = 3
La fórmula empírica del compuesto será, por tanto, Al2S3
AV - Reflexión
Ya vimos que la fórmula molecular puede coincidir con la fórmula empírica o ser un múltiplo de ella. En este caso, para hallar la fórmula molecular multiplicaremos la fórmula empírica por un número entero "n", que será el cociente de dividir la masa molecular entre la masa de la fórmula empírica. En el butano, por ejemplo, la fórmula empírica es C2H5 y su masa molecular es 58 u. Como la masa de la fórmula empírica es 29 u, es evidente que tendremos que multiplicar por 2 (n= 58 u/29 u = 2) la fórmula empírica para obtener la molecular:
Importante
La fórmula molecular de un compuesto puede ser igual a su fórmula empírica o a un múltiplo de ella.
Fórmula molecular = (Fórmula empírica)n
Si n=1, la fórmula empírica y molecular coinciden.
AV - Reflexión
a) Su fórmula empírica.
b) Su fórmula molecular.
Datos. Masas atómicas relativas: C = 12 u; H = 1 u; O = 16 u.