3. Cálculo de la composición centesimal a partir de la fórmula
 |
| Imagen propia |
Como ya hemos indicado, la composición centesimal de una sustancia se puede obtener en el laboratorio por distintos procedimientos, y a partir de estos datos se puede hallar su fórmula.
Pero si conocemos de antemano la fórmula empírica o molecular de un compuesto, podemos hallar su composición centesimal mediante un sencillo cálculo matemático.
La fórmula molecular (o la unidad fórmula) nos indica, como hemos visto, la relación entre el número de átomos o el número de moles de cada elemento del compuesto.
Así, en 1 mol de H2SO4 (2x1 g + 32 g + 4x16 g = 98 gramos) hay 2 moles de H (2 x 1 g = 2 g), 1 mol de S (32 g) y 4 moles de O (4 x 16 g = 64 g).
Como sabes desde hace mucho tiempo, dividir es repartir. Si, por ejemplo, queremos repartir 20 canicas entre 5 niños, tendremos que dividir 20 entre 5 para saber las canicas que le corresponden a cada uno de los niños. Pues de la misma manera, si dividimos 2 g de hidrógeno entre 98 g de H2SO4, obtenemos los gramos de hidrógeno que corresponden a cada gramo del compuesto. Ahora tendremos que multiplicar por 100 para calcular la masa de hidrógeno en 100 gramos de H2SO4.
Pues así vamos a calcular el porcentaje de cada uno de los elementos que forman el compuesto:
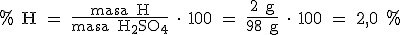
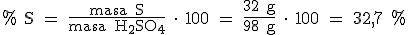
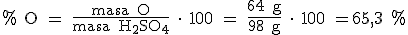
Importante
Para calcular el tanto por ciento en masa de un elemento en un compuesto realizaremos la siguiente operación:
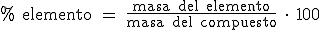
En "masa del compuesto" pondremos su masa molar y en "masa del elemento", la masa del elemento en cuestión en un mol del compuesto.
AV - Reflexión
Halla la composición centesimal del nitrato de potasio (KNO3).
Masas atómicas: K= 39,1 u; N = 14,0 u; O = 16,0 u.