1. Fórmula empírica y molecular
Curiosidad
 |
|
Partículas de Dalton. CC0 |
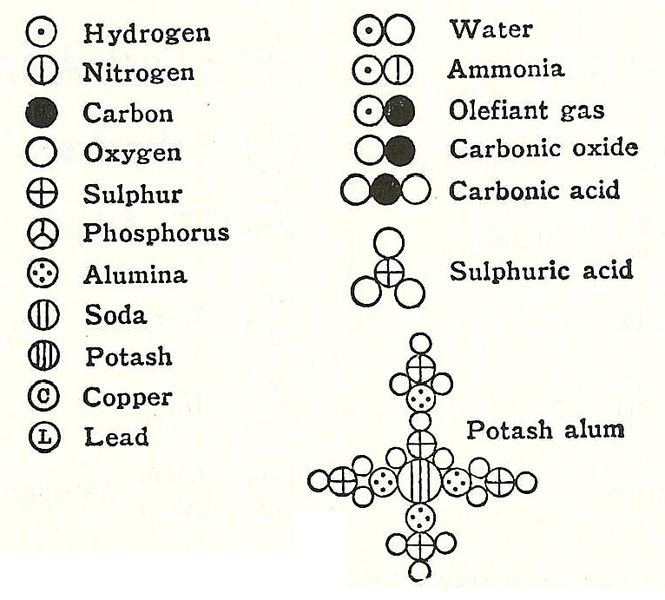
Habrás oído hablar de la alquimia. Fue una práctica desarrollada por distintas civilizaciones desde la antigüedad hasta finales del siglo XVI, que combinaba distintas artes: química, medicina, física, astrología, magia, etc. Los alquimistas, que buscaban con ahinco la piedra filosofal para poder transformar otros metales en oro y para fabricar el elixir de la larga vida, ya utilizaban símbolos para representar las sustancias que conocían.
Posteriormente Dalton (1808), que como viste en el primer tema fue el padre de la primera teoría atómica con una base experimental, propuso utilizar círculos en los que incluía trazos y letras para representar a los elementos, y así poder combinar el número adecuado de estos círculos para representar a los compuestos.
Poco después Berzelius (1814) suprimió los círculos y propuso designar a los elementos con la letra inicial de su nombre en latín, y la segunda letra si era necesario. Una vez establecidos los símbolos de los elementos se pudo empezar a representar la composición química de los compuestos mediante fórmulas muy similares a las que utilizamos actualmente. De esta manera se adoptó un lenguaje común para todos los estudiosos de la química, que es universal y fácil de entender.
Hemos visto en los temas anteriores que las sustancias puras están formadas por entidades elementales que pueden ser átomos (He, Ne,...), moléculas (O2, CO2, NH3,...) o cristales (NaCl, SiO2,...).
Pues bien, una formula química es una expresión que representa a las sustancias constituidas por moléculas o por cristales, indicando su composición química, es decir, los elementos que la forman, mediante sus símbolos, y la proporción entre el número de átomos de dichos elementos, mediante subíndices que se escriben a la derecha de cada elemento (para simplificar se omite el subíndice 1).
 |
| Wikimedia Armando-Martin CC |
Vamos a ver la diferencia entre la fórmula empírica y la fórmula molecular de un compuesto con un ejemplo:
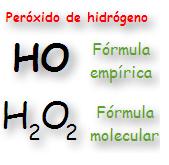
El peróxido de hidrógeno es una sustancia formada por moléculas en las que se unen dos átomos de oxígeno y dos átomos de hidrógeno.
Por tanto, su fórmula molecular sera H2O2. Como ves, la fórmula molecular indica el número de átomos de cada elemento que forman una molécula.
La fórmula empírica, en cambio, indica la relación más sencilla entre el número de átomos de los distintos elementos que forman un compuesto. En el peróxido de hidrógeno, por cada átomo de H hay un átomo de O, y su fórmula empírica será HO.
Solo podemos asignar una fórmula molecular a los compuestos que están formados por moléculas.
Vamos a ver algunos ejemplos:
| SUSTANCIA | TIPO DE PARTÍCULAS | FÓRMULA MOLECULAR | FÓRMULA EMPÍRICA |
| Dioxígeno | moléculas | O2 | O |
| Amoníaco | moléculas | NH3 | NH3 |
| Cloruro de sodio |
cristales | - | NaCl |
| Etino | moléculas | C2H2 | CH |
| Benceno | moléculas | C6H6 | CH |
Si te fijas en el etino y el benceno observarás que tienen distinta fórmula molecular pero la misma fórmula empírica. La fórmula molecular es un múltiplo de la fórmula empírica. Por ejemplo, la fórmula molecular del benceno es seis veces su fórmula empírica.
Importante
La fórmula empírica de un compuesto indica la proporción más sencilla entre el número de átomos de los distintos elementos que lo forman.
La fórmula molecular expresa el número de átomos de cada elemento que forman una molécula. La formula molecular de una sustancia pura puede coincidir con su fórmula empírica o ser un múltiplo de ella.
AV - Pregunta de Elección Múltiple
Una fórmula química se puede interpretar de distintas maneras:
| ¿Qué representamos con la fórmula H2O? |
||
| A un nivel no observable | A un nivel observable | |
| Una molécula de agua |
Una sustancia pura llamada agua
|
Un mol de agua |
 |
 |
 |
| Flickr. Aitor Agirregabiria. Lic Creative C. | 1 mol de agua Imagen propia | |
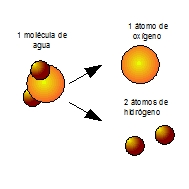
- A un NIVEL NO OBSERVABLE (que no podemos ver) representa a una molécula e indica el número de átomos de cada elemento que la forman, o la relación entre el número de átomos de los distintos elementos que forman un cristal. Por ejemplo, HNO3 representa a una molécula de ácido nítrico e indica que está formada por la unión de un átomo de hidrógeno, un átomo de nitrógeno y tres átomos de oxígeno; y NaCl indica que en un cristal de cloruro de sodio, por cada átomo de sodio hay un átomo de cloro.
- A un NIVEL OBSERVABLE representa:
- A una sustancia pura. Por ejemplo, H2O representa al agua, una sustancia muy conocida por nosotros e imprescindible para la vida.
- A un mol de dicha sustancia, indicando los moles de los distintos elementos contenidos en él. Por ejemplo, CO2 representa a un mol de dióxido de carbono, es decir, a 44 g de CO2, e indica que en ese mol hay 1 mol de átomos de carbono (12 g) y 2 moles de átomos de oxígeno (2 x 16 g = 32 g).
FÓRMULAS ESTRUCTURALES
La fórmula molecular indica el número de átomos de cada elemento que
forman una molécula, pero no nos da información de cómo están estos
unidos entre sí.
Para ello se utilizan, sobre todo en química orgánica, las fórmulas estructurales, que
muestran el orden en el que se unen los átomos y el tipo de enlace que
se produce entre ellos (como veremos más adelante, los átomos de una
molécula se pueden unir por enlaces simples, dobles o triples).
En las fórmulas estructurales de los compuestos orgánicos se pueden indicar los enlaces entre todos los átomos (fórmulas desarrolladas) o sólo los enlaces entre los átomos de carbono (fórmulas semidesarrolladas):
| Compuesto | Fórmula molecular |
Fórmula desarrollada | Fórmula semidesarrollada |
| metano | CH4 |
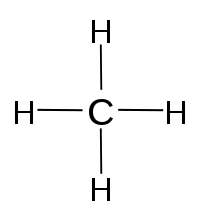
|
— |
| butano | C4H10 |
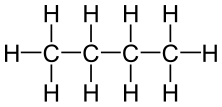
|
CH3-CH2-CH2-CH3 |
| etanol | C2H6O |

|
CH3-CH2OH |
| eteno | C2H4 |
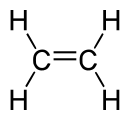
|
CH2=CH2 |
| etino | C2H2 |
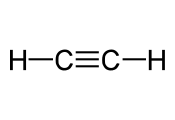
|
CH≡CH |
Curiosidad
La mayoría de las moléculas son tridimensionales y las fórmulas estructurales no nos proporcionan información a cerca de cómo están dispuestos en el espacio los distintos átomos que forman la molécula. Para entender mejor la estructura de las moléculas y cómo tienen lugar las transformaciones químicas, se utilizan desde hace mucho tiempo las fórmulas en perpestiva, las proyecciones en un plano y los modelos moleculares de distinto tipo, que indican gráficamente la geometría de la molécula; es decir, cómo se disponen en el espacio los distintos átomos, los ángulos que forman los distintos enlaces y la distancia relativa entre los átomos que forman estos enlaces.
Hoy en día existen numerosos programas informáticos que generan modelos moleculares que se pueden girar para observar las moléculas desde distintos puntos de vista.
|
CH4
(metano) |
|
| Fórmula molecular |
Fórmula en perpestiva Modelo de bolas y varillas Modelo compacto |
| Wikimedia. Dominio Público |