1.1 Adición
Este tipo de reacción la sufren las especies insaturadas, es decir, compuestos con enlaces múltiples.
Son reacciones en las que se rompe el enlace pi de un doble enlace, más débil que el sigma, entrando dos grupos en los átomos que estaban unidos por el doble enlace. Según cuál sea el grupo añadido se forman diferentes sustancias: si se añade H2, se obtienen hidrocarburos saturados; si es H2O, alcoholes; si es HCl, derivados clorados; etc. Veamos caso por caso:
Hidrogenación:
consiste en la adición de una molécula de hidrógeno (H2) a un doble enlace, rompiéndose este y dando lugar a la formación del alcano correspondiente.
![]()
Estas reacciones precisan de un catalizador, los más comunes son el níquel, paladio o el platino.
Halogenación:
el sustrato es una molécula orgánica con doble (o trilpe) enlace y el reactivo en este caso es una molécula de halógeno.
![]()
Como ves, cada átomo de la molécula de reactivo se une a un átomo de Carbono partícipe del doble enlace.
Hidrohalogenación:
En este caso el reactivo es un haluro de hidrógeno. Como en este caso el reactivo se compone de dos átomos distintos se formarán dos compuestos distintos, pero uno de ellos lo hará de forma mayoritaria, se cumple la llamada regla de Markovnikov
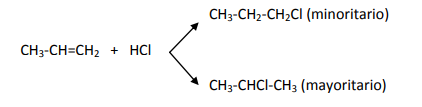
El hidrógeno se adiciona al Carbono con más hidrógenos
Actividad
Según la regla de Markovnikov el Hidrógeno se unirá mayoritariamente al carbono que tiene más Hidrógenos.
Te ayudará a recordar si piensas que es una regla insolidaria, ya que "le da al que más tiene".
Formación de alcoholes:
el reactivo es una molécula de agua (H2O). A un carbono del doble enlace se le une un H+ y al otro carbono se le une el OH-.
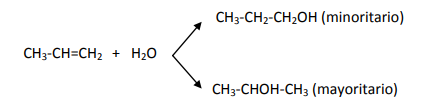
Como ves, también se cumple la regla de Markovnikov.