2. Formulación y nomenclatura de compuestos inorgánicos
Todas las sustancias se conocen por su nombre, mientras que su fórmula permite conocer su composición. La nomenclatura facilita el paso de la fórmula química al nombre de la sustancia y viceversa.
En las fórmulas químicas de los compuestos inorgánicos formados al menos por dos elementos diferentes, la posición de los elementos sigue el orden creciente de electronegatividad (medida del poder de un átomo o grupo de átomos para atraer electrones).
Por convenio, la electronegatividad desciende en el sentido indicado por las flechas (relacionado con su estructura electrónica y posición en la Tabla Periódica):
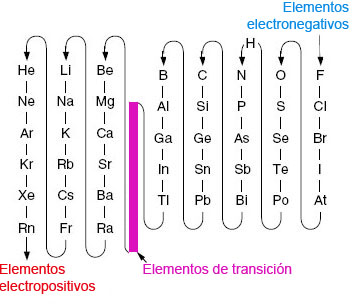 |
| Imagen de elaboración propia |
Se establece que:
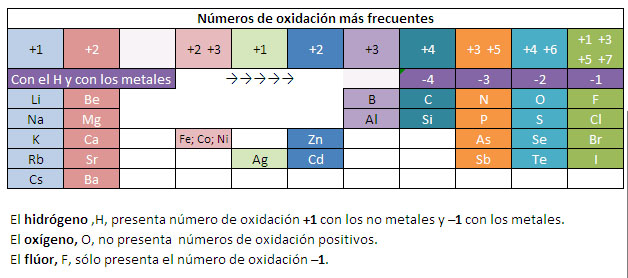
- El número de oxidación de un ion simple coincide con su carga.
- En un elemento, el número de oxidación de los átomos es cero.
- La suma de los números de oxidación de los átomos que constituyen un compuesto neutro, multiplicados por los correspondientes subíndices, es cero.
- El número de oxidación del hidrógeno es +1 cuando se combina con elementos no metálicos y -1 cuando se combina con elementos metálicos.
- El número de oxidación del oxígeno es -2, salvo en los peróxidos, en los que es -1.
Comprueba lo aprendido
El número de oxidación del azufre (S) en el H2SO4 es -6.
Retroalimentación
Falso
En efecto:
4 · nº de oxidación del oxígeno(-2) + 2 · nº de oxidación del hidrógeno (+1) + nº de oxidación del azufre = 0
4 · (-2) + 2 · (+1) + nº de oxidación del S = 0
nº de oxidación del S = + 6