2.3 Primer Principio de la Termodinámica
 |
| Imagen de Aushulz en Wikimedia Commons. CC |
El contenido energético que tiene un cuerpo no se puede medir, lo que sí podemos estimar son los intercambios de energía entre el cuerpo y su entorno.
Ya sabes que hay dos formas de transferir energía:
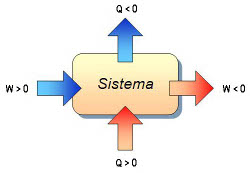
a) intercambiando calor (Q): poniendo en contacto dos cuerpos que estén a distinta temperatura. Se mide en calorías.
b) realizando un trabajo(W): aplicando al sistema una fuerza capaz de provocar en el mismo un desplazamiento. Se mide en Julios.
Esta variación energética del sistema se puede expresar como
ΔU = Q + W
Esta expresión matemática es una forma de enunciado del Primer Principio de la Termodinámica.
De acuerdo con el convenio de signos de la imagen, la energía comunicada al sistema desde el entorno se considera positiva, ya que hace aumentar la energía interna del sistema (ΔU>0), mientras que la energía cedida por el sistema es negativa, porque en ese caso ΔU<0.
Fíjate en que siempre hay la misma cantidad de energía en el universo antes y después de la evolución del sistema, pero ha podido variar su distribución: si aumenta en el sistema, disminuye en el entorno, y al revés. Por esa razón se suele decir que la energía no se crea ni se destruye, sino que solamente se transforma de unas formas a otras y se distribuye de unos sistemas a otros.
| ΔU > 0 | El sistema recibe energía | En forma de calor y/o trabajo |
| ΔU < 0 | El sistema da energía | En forma de calor y/o trabajo |
| ΔU = 0 | El sistema mantiene su energía | Recibe calor y realiza trabajo o cede calor y recibe trabajo |
Importante
Evolución de sistemas aislados
Como en un sistema aislado no se puede intercambiar energía (es decir, Q=0 y W=0), su variación de energía interna es nula cuando evoluciona. Es decir, su energía interna se conserva.
La energía interna como función de estado
| Imagen de elaboración propia |
Fíjate en la imagen. La energía potencial gravitatoria de los dos excursionistas es la misma aun cuando ellos tomaron caminos diferentes para llegar a la cima de la montaña partiendo del mismo punto. El trabajo realizado por cada uno de los excursionistas, sin embargo, ha sido distinto. Por tanto, el calor intercambiado en cada recorrido también será distinto. Se dice que la energía potencial gravitatoria es función de estado: en una transformación solamente depende de los estados inicial y final y no del camino seguido, ni de las etapas realizadas.
Sin embargo, el calor y el trabajo NO son funciones de estado. El calor y el trabajo NO son propiedades de un sistema. Un sistema tiene temperatura, presión, energía interna, ..., pero NO TIENE calor ni trabajo. El calor y el trabajo son formas en las que se transfiere la energía de unos sistemas a otros y sus valores dependen del proceso por el que se transfieren.
Por lo visto anteriormente, sería muy conveniente trabajar con funciones de estado. La energía interna, y también el resto de magnitudes termodinámicas, son funciones de estado.
Importante
Equivalente mecánico del calor
Queda claro pues, que tanto calor como trabajo son formas de transmisión de energía, pero ¿qué relación hay entre estas magnitudes?
Joule llevó a cabo un experimento, diseñando un sistema de poleas. Gracias al experimento de Joule se determina el equivalente mecánico del calor, es decir, la relación entre la unidad de energía y la unidad de calor:
1 caloría = 4,18 Julios
Puedes leer más sobre este experimento en esta web.
Para saber más
 |
| Simulación de Marcin en Wikimedia Commons. CC |
La masa y la energía
Cabría suponer que como en las reacciones nucleares aparece una enorme cantidad de energía y hay una muy pequeña disminución de la masa del sistema cerrado, dejaría de cumplirse el Primer Principio y podría suponerse un fallo en el mismo. Pero ya Einstein resolvió el problema al encontrar una equivalencia entre la masa que desaparece y la energía producida, lo que permite continuar suponiendo válido el Primer Principio de la Termodinámica al extenderlo a la conservación del binomio masa-energía, de acuerdo con su famosa ecuación:
E = mc^2