Descripción de la tarea

La glucosa, de forma libre o combinada, es el compuesto orgánico más abundante en la naturaleza. Las células utilizan la glucosa como fuente primaria de energía, siendo el combustible de la respiración celular.
La respiración celular se define como el conjunto de reacciones mediante las cuales, determinados compuestos orgánicos son degradados hasta convertirse en sustancias inorgánicas y liberándose energía.

Experimentalmente se ha determinado que la glucosa tiene una masa molecular de 180.16 g/mol y que su composición centesimal es la siguiente: 40.00% de carbono, 53.29% de oxígeno y 6.71% de hidrógeno.
1.- Determina la fórmula molecular de la glucosa con los datos anteriores.
2.- Indica dos posibles isómeros de la glucosa, explicando el tipo de isomería que presentan.
En la respiración celular, la glucosa se descompone en presencia de oxígeno produciendo dióxido de carbono y agua y liberándose energía.
3.- Escribe y ajusta la ecuación química correspondiente.
Considera que inicialmente se parte de 1.5 moles de glucosa.
4.- Calcula el número de gramos y el número de moléculas que corresponde a dicha cantidad.
5.- Determina la masa de oxígeno que reaccionará con esta determinada cantidad de glucosa e indica la masa de los productos resultantes.
6.- Imagina que reaccionan 200 mL de una disolución de glucosa de 2.3 g/L de concentración con 7 L de oxígeno gaseoso. Determina el volumen de CO2 que se obtendría, si se trabaja en condiciones normales. ¿Y si el rendimiento de la reacción es del 80%?
El dióxido de carbono es uno de los gases responsables del efecto invernadero.
7.- Argumenta las medidas que pueden tomarse para mitigar el cambio climático, a partir de la información que se ofrece en el siguiente texto científico.
Cuando el cuerpo se expone al plomo (al inhalarlo, al ingerirlo o, en una cantidad reducida de casos, al absorberlo a través de la piel), esta sustancia puede actuar como un veneno. En cuanto el plomo entra en el organismo de una persona, se distribuye por todo el cuerpo del mismo modo que los minerales favorables para el organismo, como el hierro, el calcio y el zinc. Pero el plomo puede ocasionar daños en todas las partes del cuerpo donde se deposita. Por ejemplo, en el torrente sanguíneo, puede alterar las células sanguíneas y limitar la capacidad de los glóbulos rojos para transportar oxígeno a los órganos y tejidos que lo necesitan, provocando, por lo tanto, una anemia (es lo que ocurre en el caso de exposiciones moderadas a este metal).
8.- Calcula la masa atómica del plomo a partir del espectro de masas de los isótopos de este elemento y su proporción isotópica.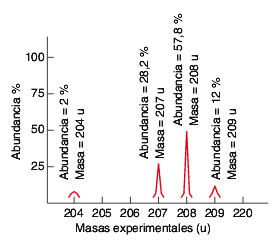
Reflexión sobre la tarea
Al final de tu tarea deberás realizar una reflexión en la que expreses qué has aprendido con esta tarea, el tiempo que le has dedicado y tu opinión personal sobre ella, entre otros aspectos. En el aula encontrarás un cuestionario en el que podrás realizar esta reflexión.
![]()
Antes de abordar esta tarea, es recomendable haber trabajado las tareas individuales planteadas en el trimestre porque en ella se habrán trabajado los contenidos necesarios para afrontar esta tarea de la forma adecuada.