1.1 Polaridad y puentes de hidrógeno
Polaridad de la molécula de agua
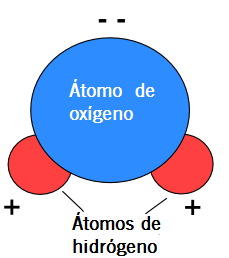
Aunque la molécula de agua es neutra, carece de carga eléctrica, dentro de ella se pueden distinguir dos zonas con cierta carga: una positiva y otra negativa. Estas dos zonas eléctricas se compensan y hacen que la carga total sea nula (cero).
El fenómeno de cargas parciales dentro de la molécula recibe el nombre de polaridad y las moléculas que presentan esta distribución de su carga eléctrica se conocen como dipolos.
En el caso de la molécula de agua, la carga negativa la presenta el átomo de oxígeno y la carga positiva, los dos átomos de hidrógeno.
 |
| Elaboración propia |
El hecho de que el agua sea un dipolo se debe a que el hidrógeno y el oxígeno son átomos muy distintos desde el punto de vista de la electronegatividad (la electronegatividad es la propiedad que indica la forma en que un átomo atrae hacia sí los electrones que comparte con otro en un enlace).
El oxígeno es un átomo muy electronegativo y el hidrógeno es un átomo muy poco electronegativo. Los electrones que comparten los dos enlaces que presenta la molécula de agua están desplazados hacia la región ocupada por el oxígeno. La zona del oxígeno presentará una cierta carga negativa y la de los hidrógenos positiva. La molécula está polarizada.
La polaridad de la molécula es la responsable de su unión con otras moléculas de agua a través de lo que se conoce como puentes de hidrógeno, que vamos a ver a continuación.
Importante
La molécula de agua es neutra pero presenta un comportamiento dipolar, esto es, presenta una ligera carga negativa hacia el átomo de oxígeno y otra ligera carga positiva hacia los dos átomos de hidrógeno.
Enlaces entre moléculas de agua: puentes de hidrógeno
Entre las moléculas de agua se establece un tipo de enlace intermolecular débil: el enlace por puentes de hidrógeno. Un enlace por puentes de hidrógeno se establece necesariamente entre un átomo con una ligera carga negativa (en este caso el oxígeno) y otro con una ligera carga positiva (en este caso un átomo de hidrógeno).
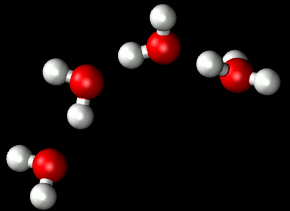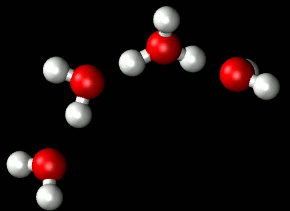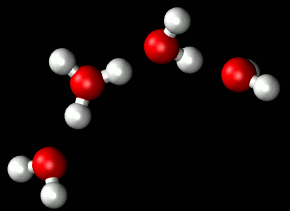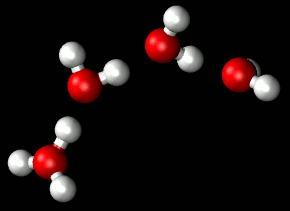 |
| Puentes de hidrógeno Imagen de Matt K. Petersen en Wikimedia . Dominio público |
Una molécula de agua puede unirse con hasta otras cuatro moléculas diferentes de agua, aunque los enlaces de hidrógeno se forman y destruyen de manera muy rápida: la duración de cada enlace en el agua líquida viene a ser del orden de 10-21s .
Pueden formarse grupos de 3, 4 y hasta 9 moléculas de agua. Con ello se alcanzan pesos moleculares relativamente altos que son la causa de que el agua sea líquida a temperatura ambiente y tenga todas las propiedades típicas de un fluido.
Comprueba lo aprendido
Retroalimentación
Falso
La molécula de agua es neutra, aunque presenta un comportamiento dipolar.
Retroalimentación
Falso
Los átomos que forman la molécula de agua sí forman enlaces fuertes (el enlace hidrógeno-oxígeno) pero los enlaces intermoleculares son débiles.
Retroalimentación
Verdadero
¡Es cierto!