1. Introducción: Espontaneidad de las reacciones
Ya has visto que cuando una reacción química se produce puede liberar energía en forma de calor, originando un aumento de temperatura del sistema (reacción exotérmica). En otros casos, necesita energía para producirse, que se puede aportar desde el exterior o bien extraerse de la energía térmica del mismo sistema, originándose en ese caso una disminución de temperatura (reacción endotérmica).
En la naturaleza hay procesos que se producen espontáneamente y otros que no lo hacen. El Primer Principio de la Termodinámica hace referencia a que sólo pueden ocurrir procesos en los que la energía total del Universo se conserva. Sin embargo, no permite explicar por qué unos procesos suceden y otros no.
El ejemplo más característico es la expansión de un gas: se trata de un gas encerrado en un matraz mediante una llave, y que, al abrirla, se expansiona a temperatura constante a otro matraz, en el que previamente se había hecho el vacío, como puedes ver en la imagen. El gas se distribuye uniformemente entre ambos matraces, pero nunca se da el caso contrario, que un gas encerrado en dos matraces se concentre espontáneamente en uno solo.
Existen muchos otros casos (tiene otros dos ejemplos en la imagen) en los que un sistema evoluciona espontáneamente en un sentido, pero nunca ocurre en el sentido inverso.
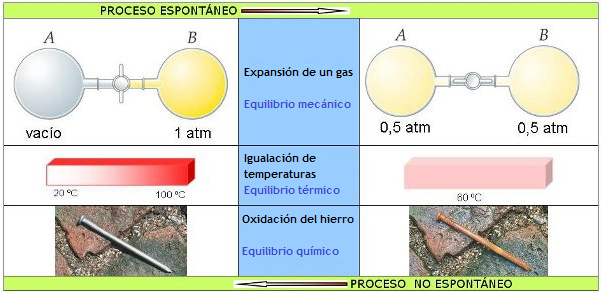 |
| Imagen de elaboración propia |
Hay también muchas reacciones químicas, como por ejemplo las reacciones de combustión y, sobre todo, las reacciones explosivas, que siempre se realizan en un sentido y nunca en el sentido contrario.
La experiencia indica que todo sistema aislado evoluciona en un sentido hasta alcanzar el estado de equilibrio -situación en la que las propiedades del sistema ya no cambian-, momento a partir del cual no se observa que esté evolucionando. De esa forma, en la expansión del gas llega un momento en que ya no hay evolución observable: cuando el gas está distribuido homogéneamente en el recipiente se ha alcanzado el equilibrio mecánico. De forma similar se alcanzan el equilibrio térmico y el químico.
Curiosidad
Primer principio y espontaneidad de los procesos
El primer principio de la Termodinámica no se puede utilizar para conocer la evolución de un sistema. De esta forma, con el primer principio podría suceder que un objeto se elevara en el aire, con tal que su contorno se enfriara en la medida precisa para producir el trabajo necesario a fin de vencer la fuerza gravitatoria. De igual modo, sería posible, de acuerdo con el primer principio, que en una barra metálica de temperatura uniforme se produjera espontáneamente una diferencia de temperaturas, con tal de que el calor recibido por el extremo caliente fuese igual al cedido por el frío.
Importante
Procesos reversibles e irreversibles
Una reacción irreversible es aquella que ocurre en un solo sentido, de forma que acaba cuando se agotan los reactivos y por tanto no hay forma de revertir el proceso, no ocurre de manera espontánea.
Un ejemplo es la combustión del butano:
C_3H_8 + 5O_2 → 3CO_2 + 4H_2O
una vez se queme no podemos volver a obtener el compuesto de partida.
Por el contrario, en los procesos reversibles sí puede invertirse el sentido de la reacción. Los reactivos no se transforman completamente a productos, sino que se llega a un estado de equilibrio en el que se dan los dos procesos (directo e inverso).
Un proceso reversible es el que puede revertirse a la situación de partida.