3.1 Fuerza oxidante y reductora
Lo mismo que en el caso de ácidos y bases, el concepto de oxidante o reductor es relativo: una sustancia se oxida o se reduce dependiendo de con qué sustancia se enfrente. Por ejemplo, el peróxido de hidrógeno (agua oxigenada), H2O2, que actúa habitualmente como oxidante, puede hacerlo como reductor frente a oxidantes más potentes que él, como el permanganato de potasio, KMnO4.
Se puede establecer una escala de la fuerza relativa de los pares redox: cuanto mayor es la tendencia a ceder electrones, mayor es el poder reductor, y cuanto mayor es la tendencia a captarlos, mayor es el poder oxidante.
La fuerza oxidante y reductora es fácil de interpretar en casos sencillos. Por ejemplo, los átomos de Na tienen tendencia a ceder un electrón, para estabilizarse según el modelo de octete electrónico, con lo que se oxidan; los atomos de cloro tienden a ganar un electrón (por la misma razón), reduciéndose. Por tanto, al hacer reaccionar ambas sustancias se transfiere un electrón de un átomo de Na a uno de Cl, ionizándose ambos (Na+ y Cl-) en un proceso redox.
Es decir, los átomos muy electronegativos son oxidantes, mientras que los poco electronegativos son reductores.
De la misma forma, puedes entender fácilmente que si un reductor es fuerte, su oxidante conjugado será débil, y a la inversa, un oxidante fuerte tiene como conjugado un reductor débil.
En el tema siguiente verás cómo se establece una escala cuantitativa que permite comparar la capacidad oxidante o reductora de las sustancias.
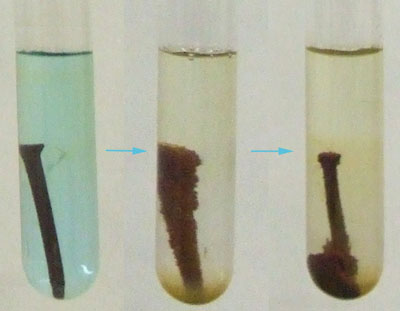 |
| Imagen 8 Elaboración propia |
En la imagen puedes ver la consecuencia de introducir un clavo de hierro en una disolución de sulfato de cobre. Se da la reacción entre el hierro y los iones cobre (II). La reacción es Fe(s) + Cu2+(aq) ↔ Fe2+(aq) + Cu(s). En el proceso se oxida el Fe a Fe2+, desapareciendo hierro del clavo y formándose iones hierro en disolución, mientras que se reduce el Cu2+ a Cu, desapareciendo iones Cu2+ de la disolución (que por esa razón pierde el color azul) y se forma cobre metálico sobre el clavo de hierro.
Oxidantes y reductores de uso habitual
En la tabla siguiente puedes ver los oxidantes y reductores más habituales.
| Oxidantes | Halógenos: F2, Cl2, Br2 y I2 Oxígeno: O2 Oxoaniones: NO3-, IO3-, MnO4-, Cr2O72- |
| Reductores |
Metales alcalinos y alcalino-térreos: Li, Na, Mg, Ca |