3. Por qué se unen los átomos. Teoría de Lewis sobre el enlace
Pre-conocimiento
Como es natural, los átomos se unirán para ganar estabilidad. Es decir, es más estable (tiene menos energía) la situación en que los átomos están unidos que aquella en la que están alejados.
| Imagen de Física y Química en flash, Uso educativo |
Observa la animación de la derecha y analiza por qué se unen los átomos. Imagina que tienes dos átomos situados muy lejos uno de otro (estarán en estado gaseoso). Entre los dos tienen una cantidad de energía determinada, y su energía de interacción es nula. Conforme se van acercando, interaccionan entre ellos, de forma que la situación va siendo progresivamente más estable, de menor energía, como puedes observar en la línea que representa la energía. A una distancia concreta, la energía es mínima porque la interacción es máxima entre los núcleos y los electrones de ambos átomos.
Si los átomos se acercaran más, las repulsiones entre los electrones y los núcleos ya serían mayores, con lo que la situación sería menos estable, como se muestra en el ascenso de la línea de la energía.
Es decir, los átomos se unen porque la energía que tiene el conjunto de átomos cuando están unidos es menor que cuando están separados y los átomos unidos se sitúan a la distancia a la que la energía es mínima.
La disminución de energía entre la situación de átomos separados y de átomos unidos tiene un significado real muy sencillo: para separar de nuevo los dos átomos habrá que comunicar precisamente esa cantidad de energía, llamada energía de enlace. Además , la distancia a la que quedan los átomos unidos se le denomina longitud de enlace.
A principios del siglo XX se conoce el papel del electrón en la capacidad de combinación de los átomos. Se observó que al reaccionar elementos halógenos con alcalinos ambos átomos forman iones, uno positivo y otro negativo, adquiriendo ambos estructura electrónica de gas noble.
Esta estructura electrónica de gas noble resulta particularmente estable, ya que los átomos de gases nobles no reaccionan en las condiciones químicas habituales y son los únicos elementos que se encuentran en la naturaleza como átomos aislados en las condiciones estándar, sin formar moléculas.
Como la última capa electrónica de los gases nobles está completa con ocho electrones (excepto en el helio, que tiene dos), la tendencia a adquirir estructura de gas noble se conoce como regla del octeto.
 |
 |
| Imagen de Frazzydee, Creative commons |
Imagen de Elaboración propia |
Actividad
Regla del octeto:
Todos los átomos tienen tendencia a conseguir en la última capa la configuración electrónica del gas noble más próximo, para lo que ceden, aceptan o comparten electrones, dando lugar a los diferentes tipos de enlace.
La regla del octeto, enunciada por el fisicoquímico estadounidense Lewis en 1917, es un modelo cualitativo muy simple que, a pesar de tener algunas excepciones, ayuda muchísimo a comprender las uniones entre átomos. Lewis además, ideó una representación de los átomos, llamada diagrama de Lewis, que simplifica enormemente la representación de las moléculas y que consiste en representar a los átomos por su símbolo y rodearlos por tantos puntos como electrones tengan en la capa de valencia. Cuando los átomos se aproximan entre sí aceptan, ceden, o comparten electrones para conseguir el octeto, cuatro pares de electrones, dando lugar a enlaces de diferentes tipos.
 |
| Imagen de elaboración propia |
 |
| Imagen de elaboración propia |
El octeto se puede alcanzar de dos formas. En primer lugar, por transferencia de electrones, cuando unos átomos pierden electrones formando cationes y otros los ganan dando lugar a aniones. Esto sucede cuando se unen los metales, elementos poco electronegativos, con no metales, que son muy electronegativos.
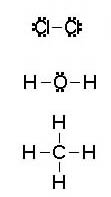
Sin embargo, cuando se ponen en contacto átomos de no metal, los dos tipos de átomos necesitan ganar electrones para completar su capa más externa: la única forma de completarla es compartir electrones, de manera que dos electrones que inicialmente eran uno de cada átomo, pasan a pertenecer ambos a los dos átomos, con lo que en definitiva cada uno está rodeado por un electrón más.
Fíjate en la imagen. Los pares de electrones se indican con dos puntos o una raya. Todos los átomos están rodeados por 4 pares, excepto el hidrógeno, que solamente está rodeado por uno, ya que la primera capa electrónica no tiene más que dos electrones.
AV - Reflexión
Justifica las estructuras de Lewis de la imagen anterior (Cl2, H2O y CH4).