7. Solubilidad de compuestos iónicos poco solubles
Conocimiento previo
Los equilibrios de solubilidad tienen gran importancia en Química. Permiten resolver problemas como la recuperación de sustancias muy caras que están en disolución, como el ion Ag+, o la detección y eliminación de las disoluciones de iones tóxicos para los organismos vivos. Otros procesos relacionados con equilbrios de solubilidad son la formación de cavernas de piedra caliza, el ablandamiento del agua dura, la formación de cálculos renales o las caries dentales, como verás en este tema.
La solubilidad de una sustancia es la máxima cantidad de la misma que puede disolverse en un determinado volumen (o masa) de disolvente o disolución a una temperatura determinada, y corresponde a la concentración de la disolución saturada.
Los casos más interesantes son las disoluciones acuosas. La solubilidad de una sustancia en agua, a una temperatura dada, es un valor constante y característico de cada sustancia. Se mide generalmente en moles o gramos de sólido disuelto por litro de disolución (realmente se mide en cantidad de soluto por litro de disolvente pero si tratamos sustancias poco solubles, al añadir una cantidad de sólido muy pequeña a un litro de agua el volumen de la disolución casi no varía, y sigue siendo prácticamente de un litro; por esta razón, son equivalentes las medidas de solubilidad por litro de disolvente o por litro de disolución).
Fíjate en la imagen. Al disolver una sustancia, los iones se separan y se reparten por la disolución. Pero llega un momento, ya no se disuelve más sólido, la disolución se satura y los cristales sin disolver precipitan al fondo del recipiente.
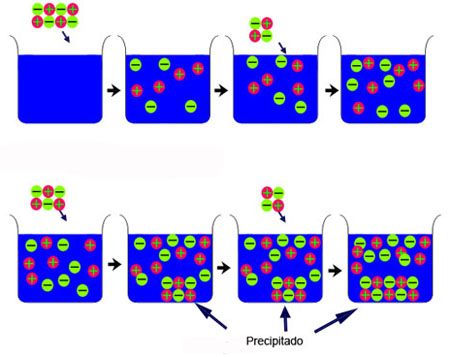 |
| Imagen Romary, Creative commons |
Un ejemplo típico de estas últimas sales lo constituye el cloruro de plata, AgCl. Cuando esta sal se añade al agua no se disuelve una cantidad apreciable de sólido. Una vez se alcanza el equilibrio entre el AgCl sólido y sus iones en disolución acuosa se dice que la disolución está saturada:
AgCl(s) + H2O ![]() Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
Así, cuando la disolución se satura no se disuelve más sólido. En realidad, se alcanza un estado de equilibrio entre los iones disueltos y los que quedan sin disolver en el sólido: existe un equilibrio dinámico, de modo que tantos iones como se disuelven por unidad de tiempo vuelven a precipitar, transformándose de nuevo en sólido.