7.1 La constante de solubilidad
Siendo rigurosos, no se puede decir que una sal sea completamente insoluble. Aun en las sustancias menos solubles, existe un equilibrio entre la sustancia sólida sin disolver y sus iones en disolución.
Así, por ejemplo, si disuelves una sal poco soluble como el AgCl en agua, se establecerá el siguiente equilibrio: AgCl(s) + H2O ![]() Ag+(aq) + Cl-(aq). En las llamadas sales insolubles, este equilibrio está casi totalmente desplazado hacia la izquierda, pero existen unas concentraciones (aunque muy pequeñas) de iones Ag+ y Cl-, que deben cumplir con la ley del equilibrio químico, esto es:
Ag+(aq) + Cl-(aq). En las llamadas sales insolubles, este equilibrio está casi totalmente desplazado hacia la izquierda, pero existen unas concentraciones (aunque muy pequeñas) de iones Ag+ y Cl-, que deben cumplir con la ley del equilibrio químico, esto es:
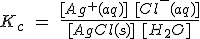
Como la concentración de la sal sólida sin disolver es constante y la del agua en disoluciones diluidas como la presente también, se puede escribir que:
donde Ks es la llamada constante de solubilidad o producto de solubilidad.
Por esta razón no se escribe nunca el agua como reactivo:
AgCl (s) ![]() Ag+ (aq) + Cl- (aq)
Ag+ (aq) + Cl- (aq)
La expresión de Ks depende de la estequiometría del compuesto: no es lo mismo que se forme un catión y un anión, que se formen dos y uno, etc. En la tabla puedes ver algunos ejemplos, en los que s es la solubilidad de la sustancia en mol/L.
| Equilibrio de solubilidad | Expresión de Ks | Relación entre Ks y s |
| AgBr (s) |
Ks = [Ag+]·[Br-] | Ks = s·s = s2 |
| Ag2CrO4 (s) |
Ks= [Ag+]2·[CrO42-] | Ks = (2s)2·s= 4s3 |
| Cu(OH)2 (s) |
Ks= [Cu2+]·[OH-]2 | Ks = s·(2s)2= 4s3 |
| Al(OH)3 (s) |
Ks= [Al3+]·[OH-]3 | Ks = s·(3s)3= 27s4 |
Actividad
Determinación de solubilidades y constantes de solubilidad
Teniendo el dato de Ks puedes conocer la solubilidad de la sustancia y, al revés, conociendo la solubilidad (expresada como concentración) puedes calcular Ks.