4. Cálculo del calor de reacción
Pre-conocimiento
 |
| Imagen de teclasorg en Flickr. CC |
La energía química no está en los átomos.
Como ya se ha comentado, la energía química está almacenada en los enlaces que tienen lugar entre los átomos que forman las sustancias. Por eso podemos calcular el calor transferido en una reacción química, simplemente haciendo un balance de los enlaces que se destruyen y se forman en la reacción.
 |
|
Imagen de Lin Linao en Wikimedia. CC |
Para el químico, resulta de mucho interés saber la cantidad de calor que interviene en una reacción química. En algunos casos, es necesario comunicar energía en forma de calor para que la reacción se produzca (proceso endotérmico), y eso supone un coste económico para suministrar esa energía al sistema. En otros, se desprende energía al transformase los reactivos en productos (proceso exotérmico) y ahora el coste es de instalación, porque hay que refrigerar el reactor, que debe soportar temperaturas altas, aunque el calor desprendido se puede aprovechar (por ejemplo, para calefacción).
Los combustibles tiene diferente capacidad para producir calor en función de cuánto calor desprenden al quemarse, por lo que se necesita saber su calor de combustión. ¿Qué sustancia proporciona más calor al quemarse, el propano o el butano, que son dos de los gases más utilizados? ¿Y qué tal resultado dan la madera o el carbón?
Además, resultaría muy interesante poder saber esos valores sin tener que medirlos experimentalmente, utilizando datos de otras reacciones o consultando tablas de datos.
Aunque existen varios procedimientos, el más sencillo es a partir de las energías de enlace, también llamdas entalpías de enlace. Para lo que tenemos que saber qué enlaces se rompen y se forman con el transcurso de la reacción. El inconveniente de este método es que el resultado que se obtiene es sólo aproximada, pero más que suficiente para el propósito de este tema.
|
Energía de Enlace Entalpía de enlace |
kJ/mol |
|
C - H |
412 |
|
C - C |
348 |
|
C = C |
612 |
|
C ≡ C |
837 |
|
C - C (benceno) |
518 |
|
C - O |
360 |
|
C = O |
743 |
|
C - N |
305 |
|
C -N |
615 |
|
C ≡ N |
891 |
|
C -Cl |
338 |
|
C - Br |
276 |
|
C - I |
238 |
|
F - F |
151 |
|
Cl - Cl |
242 |
|
Br - Br |
193 |
|
I - I |
151 |
|
F - Br |
197 |
|
H -Cl |
431 |
|
H - Br |
366 |
|
H - I |
299 |
|
H - H |
436 |
|
O - O |
157 |
|
O = O |
496 |
|
O - H |
463 |
|
N - N |
163 |
|
N = N |
409 |
|
N ≡ N |
944 |
Se llama energía de enlace a la cantidad de energía necesaria para romper un mol de enlaces, es decir, 6,023 1023 enlaces. Por similitud con las definiciones de entalpías de reacción, se suele utilizar el término entalpía de enlace. Las sustancias deben estar en estado gaseoso, para que la energía comunicada se invierta exclusivamente en romper enlaces y no en cambios de estado.
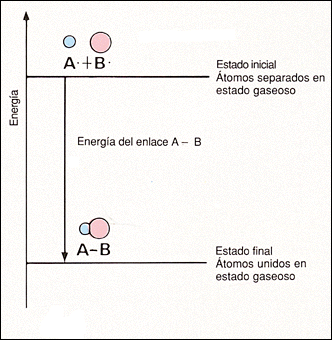 |
 |
| Imagen de elaboración propia | Imagen de elaboración propia |
Fíjate en la imagen superior: la energía química de los átomos A y B unidos es menor que cuando están separados. La energía de enlace es precisamente la disminución de energía observada, pues será el valor que habrá que comunicar para que se separen cuando están unidos.
Se trata de valores promedio, ya que la energía de un enlace C-C no es la misma en el etano que en el butano, pues en un caso sólo hay hidrógenos unidos a los átomos de carbono enlazados y en el otro hay grupos más complejos (metilo, etilo, etc). En las tablas de datos se indica la media de los valores medidos experimentalmente. Por esa razón, a veces hay diferencias apreciables entre los resultados obtenidos utilizando energías de enlace y los datos experimentales, los resultados calculados resultan pues sólo aproximados. Estas diferencias son más notables cuanto más compleja es la reacción.
Una vez tabuladas, las energías de enlace se utilizan para calcular calores de reacción. Para ello, es necesario detallar qué enlaces se rompen y se forman en la reacción, sumando las energía de enlace de los enlaces rotos y restando las de los enlaces formados. Previamente, es necesario detallar el mecanismo de reacción, es decir, los enlaces que se deben romper para que los reactivos se puedan transformar en productos, así como los enlaces formados en los productos.
Qr = ∑ nr E (enlaces rotos) - ∑ nf E (enlaces formados)
donde nr y nf son el número de enlaces de cada tipo rotos o formados en el proceso.
Actividad
Se denomina energía de enlace (ó entalpía de enlace) al la energía necesaria para romper un mol de enlaces.
El calor intercambiado en una reacción puede calcularse fácilmente restando a las energías de los enlaces rotos, las energías de los enlaces formados:
Qr = Σ Erotos - Σ Eformados
En el siguiente vídeo puedes observar la resolución de un ejercicio de cálculo del calor de reacción a partir de las energías de enlace. En el vídeo se utiliza el término entalpía de reacción y entalpía de enlace, recuerda que el término la entalpía expresa el calor intercambiado cuando el proceso se lleva a cabo a presión constante, tal y como hemos definido los calores de reacción. También se utilizan las condiciones estándar, que como ya sabes son a la presión constante de una atmósfera y la temperatura de 25 ºC.
| Vídeo de Youtube subido por |
AV - Reflexión
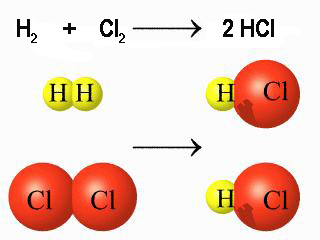
Observa la imagen superior que detalla el mecanismo de reacción en la síntesis del HCl, y calcula la energía absorbida o desprendida en el proceso. Las energías de enlace que necesites puedes localizarlas en las tablas de datos.
AV - Reflexión
Sabiendo que el calor de formación del NH3(g) es de -43 kJ/mol, determina el valor de la energía del enlace N-H utilizando los datos de las energías de enlace N≡N y H-H, que puedes consultar en la tabla.