2.5 Riqueza de una sustancia y rendimiento de una reacción
En ocasiones intervienen en las reacciones químicas sustancias que no son puras. Esto puede ser debido a que se presentan en la naturaleza en minerales que contienen otras sustancias, o a que el proceso seguido para su obtención en el laboratorio o en la industria química no ha permitido obtenerlas puras.
La riqueza o pureza de una sustancia se suele indicar en tanto por ciento en masa. Por ejemplo, que un mineral de cinc tenga una riqueza del 65%, quiere decir que en cada 100 gramos de ese mineral hay 65 g de cinc.
Imagina que tenemos 120 g de una caliza que contiene 72 g de CaCO3. ¿Cuál será la pureza en carbonato de calcio de dicha caliza? Recuerda que dividir es repartir: si dividimos los 72 g de CaCO3 entre los 120 g de caliza, hallamos los gramos de CaCO3 que hay en cada gramo de caliza. Si queremos saber la masa de CaCO3 en cada 100 gramos de caliza, tendremos que multiplicar el resultado de la división anterior por 100.
Esto quiere decir que en cada 100 g de esa caliza hay 60 g de carbonato de calcio. El factor de conversión para transformar una masa de caliza en CaCO3 será, por tanto, 60 g CaCO3/100 g caliza.
Importante
Llamamos riqueza o pureza de una sustancia a los gramos de la misma que hay en cada 100 gramos de la sustancia impura.
Ejemplo o ejercicio resuelto
El carbonato de sodio se puede obtener por descomposición térmica del hidrogenocarbonato de sodio según la reacción:
NaHCO3 → Na2CO3 + CO2 + H2O
Calcula la masa de carbonato de sodio que se puede obtener a partir de 40 gramos de hidrogenocarbonato de sodio de un 98% de riqueza.
Datos. Masas atómicas relativas: Na = 23 ; H = 1 ; C = 12 ; O = 16
La ecuación química está sin ajustar. Si cuentas los átomos de cada elemento que hay a cada lado de la flecha, te darás cuenta que a la izquierda hay la mitad de átomos que a la derecha; luego, colocando un "2" delante de NaHCO3 la ecuación estará ajustada:
| 2 NaHCO3 → Na2CO3 + CO2 + H2O
|
Como siempre, indicamos el dato que queremos calcular, el signo igual y el dato de partida:
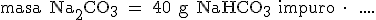
|
Si la pureza del compuesto es del 98%, en cada 100 gramos del compuesto impuro hay 98 gramos de NaHCO3:
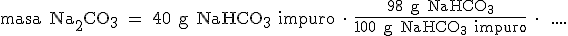
|
Ahora tenemos que transformar los gramos de hidrogenocarbonato de sodio en moles, pasar de moles de NaHCO3 a moles de Na2CO3, y de estos a gramos:

|
AV - Reflexión
Cuando se calienta clorato de potasio se descompone en cloruro de potasio y oxígeno:
2 KClO3 → 2 KCl + 3 O2
a) Calcula la masa de cloruro de potasio que se producirá a partir de 1 kg de clorato de potasio del 80% de pureza.
b) ¿Cuántos moles
de oxígeno se producirán y qué volumen ocuparán a una temperatura de 19ºC y una presión de 1,2 atm?
Datos: R = 0,082
atm.L.K-1.mol-1. Masas atómicas: O = 16 u; Cl =
35,5 u; K = 39 u.
En la mayoría de los casos la cantidad de producto que se obtiene en una reacción química es menor que la cantidad esperada. Cuando ocurre esto decimos que el rendimiento de la reacción es menor al 100%. Por ejemplo, que el rendimiento de una reacción química sea el 80% significa que de cada 100 gramos que deberíamos obtener de una sustancia obtenemos sólo 80 gramos.
Esto puede ocurrir por distintos motivos:
- Hay veces que no es posible recuperar todo el producto obtenido en la reacción, al igual que no es posible sacar toda la pasta dental de su tubo.
- Otras veces no podemos obtener toda la cantidad que esperamos de un producto, porque ocurren otras reacciones además de la que estamos considerando. Algo parecido a lo que pasa a veces con el número de croquetas que se pensaban freír. Al final se fríen menos de las previstas, porque hay alguien que se come parte de la masa antes de que se transforme en croquetas.
- Incluso ocurre con frecuencia que parte de los productos obtenidos reaccionan entre sí para originar de nuevo las sustancias iniciales.
Por tanto, se define el rendimiento de una reacción como los gramos que se obtienen de una sustancia por cada 100 gramos que se podrían haber obtenido.
Vamos a deducir con un ejemplo la fórmula para hallar el rendimiento de una reacción química. Imagina que en una reacción determinada esperamos obtener 130 gramos de una sustancia (cantidad teórica) pero sólo obtenemos 91 gramos (cantidad obtenida). Si dividimos la cantidad obtenida entre la cantidad teórica, obtenemos los gramos obtenidos por cada gramo que esperábamos obtener (91 g / 130 g). Ahora sólo tenemos que multiplicar este resultado por 100:
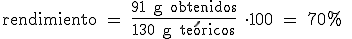
Importante
Llamamos rendimiento de una reacción a los gramos (moles, litros, etc) que se obtienen de una sustancia por cada 100 gramos (moles, litros, etc) que en teoría se podrían obtener.
Ejemplo o ejercicio resuelto
La siguiente reacción tiene, en unas condiciones determinadas, un rendimiento del 75%:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
Calcula la masa de óxido de hierro (III) que se obtiene cuando hacemos reaccionar 360 g de disulfuro de hierro con exceso de oxígeno.
Masas atómicas relativas: Fe = 55,8 ; S = 32 ; 0 =16
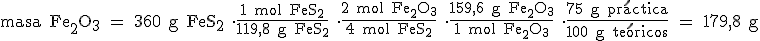
AV - Reflexión
El sulfato de sodio y el cloruro de bario reaccionan, en disolución acuosa, para dar un precipitado blanco de sulfato de bario, según la reacción:
Na2SO4 + BaCl2 → BaSO4 + 2 NaCl
Si el rendimiento de la reacción es del 80%, calcula:
a)¿Cuántos gramos de BaSO4 se forman cuando reaccionan 8,5 mL de disolución de sulfato de sodio 0,75 M con exceso de cloruro de bario?
b) ¿Cuántos mL de cloruro de bario de concentración 0,15 M son necesarios para obtener 0,6 g de sulfato de bario?
Datos: Masas atómicas relativas: O = 16 ; S = 32 ; Ba = 56