2.4 Reacciones en las que intervienen disoluciones
Curiosidad
 |
| Imagen de Lucasbosch en Wikipedia. CC |
La utilización de disoluciones nos permite trabajar en el laboratorio con cantidades más pequeñas que las que se pueden pesar con una balanza de precisión (0,0001 g).
Imagina que pesamos 1 gramo de cloruro de sodio y lo disolvemos en agua hasta preparar una disolución de 100 mL. Para ello utilizaremos un matraz aforado como el de la imagen. El gramo de soluto se repartirá homogéneamente entre los 100 mililitros de disolución por lo que habrá 0,01 g en cada mililitro.
Si cogemos ahora con una pipeta 1 mililitro de esa disolución, lo vertemos en otro matraz de 1000 mililitros vacío y añadimos agua hasta completar los 1000 mililitros, ahora tendremos 0,01 g repartido entre 1000 mililitros; por tanto, en cada mililitro de la nueva disolución habrá 0,00001 g.
En el laboratorio no podremos pesar, por ejemplo, 0,00003 g de NaCl, pero los podemos obtener tomando con una pipeta graduada 3 mililitros de la disolución anterior.
En la mayoría de las reacciones que tienen lugar en los laboratorios de química, los reactivos están disueltos en un disolvente formando una disolución.
Nosotros vamos a trabajar con disoluciones acuosas; es decir, vamos a suponer siempre que el disolvente es el agua. Vamos a simbolizar las disoluciones acuosas escribiendo (aq), de "aqua", a continuación de la fórmula del compuesto correspondiente. Por ejemplo, al escribir NaCl(aq) estamos haciendo referencia a una disolución en la que el soluto es el cloruro de sodio y el disolvente es el agua.
Ya sabes que la concentración de una disolución indica la proporción entre el soluto y el disolvente. Dicha concentración se suele expresar fundamentalmente de dos maneras:
- Indicando los moles de soluto que hay en cada litro de disolución; es decir, su molaridad.
- Indicando el porcentaje en masa de soluto y la densidad de la disolución.
La única novedad que vamos a encontrar en los problemas en los que intervienen disoluciones es que tenemos que relacionar la cantidad del soluto con el volumen y la molaridad de la disolución; o bien, con el tanto por ciento en masa y de la densidad de la misma.
¿Cómo resolvemos un problema en el que interviene la molaridad de una disolución?
Tienes que tener en cuenta que la molaridad de una disolución indica los moles de soluto que hay en cada litro de disolución. Una disolución 2 molar (2 M) de ácido clorhídrico contiene 2 moles de HCl en cada litro de disolución (2 mol/L). Por ejemplo, en un volumen de 1,5 L de ácido clorhídrico 2 M (2 mol/L), tendremos 3 mol de HCl.
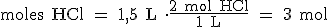
Por tanto, cuando nos dan el volumen de una disolución cuya molaridad conocemos, podemos calcular fácilmente el número de moles de soluto que hay en la misma, multiplicando por un factor de conversión que será la molaridad de la disolución.
¿Y si tienes que hallar el volumen de un ácido clorhídrico 3 M (3 mol/L) que contiene 1,8 mol de HCl? Ahora partimos de 1,8 mol de HCl, tendremos que quitar "moles" y poner "litros", luego el factor de conversión será en este caso 1 L/3 mol:
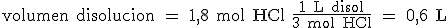
Importante
Ejemplo o ejercicio resuelto
En la reacción: NaCl + AgNO3 → AgCl + NaNO3
¿Qué masa de cloruro de plata puede obtenerse a partir de 100 mL de nitrato de plata 0,5 M?
Datos: Masas atómicas relativas: Cl = 35,5 ; Ag = 108
Lo primero que hacemos es comprobar que la ecuación química está ajustada.
Como siempre, indicamos el dato que queremos obtener, escribimos el signo "=" y el dato de partida:
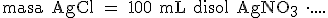
Vamos a pasar de mililitros de disolución a los moles de AgNO3, teniendo en cuenta que una disolución 0,5 M contiene 0,5 moles de AgNO3 en 1 L (1000 mL) de disolución:
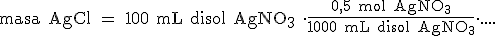
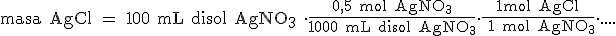
Ya solo nos queda pasar de moles a gramos de AgCl:
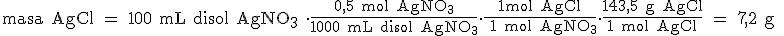
AV - Reflexión
Se mezcla cinc puro con 200 mL de disolución de HCl 6 M. La reacción que tiene lugar es:
Zn + 2 HCl → ZnCl2 + H2
Calcula:
a) La masa de cinc que reacciona.
b) El volumen de hidrógeno desprendido, medido a 27 ºC y 760 mm Hg?
Datos: R = 0’082 atm·L· K-1·mol-1. Masas atómicas: Zn = 65’4 u; Cl = 35’5 u; H = 1 u.
¿Y si en vez de la molaridad nos dan el tanto por ciento en masa de soluto y la densidad de la disolución?
En este caso tendremos que multiplicar por más de un factor de conversión.
Ya tienes que conocer estos dos conceptos:
- La densidad de una disolución indica los gramos de disolución que hay en cada mililitro de disolución. Por ejemplo, una disolución de ácido sulfúrico de densidad 1,8 g/mL, contiene 1,8 gramos de disolución en cada mililitro de disolución. Por ejemplo, si queremos hallar la masa de disolución que hay en 4,5 L de la misma, tendremos que multiplicar por el factor de conversión 1,8 g/1 mL:
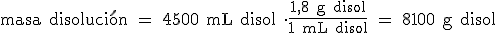
- El tanto por ciento en masa (o en peso) indica la masa de soluto que hay en 100 gramos de disolución. Por ejemplo, una disolución de ácido sulfúrico del 92%, contiene 92 gramos de H2SO4 en 100 gramos de disolución (92 g de H2SO4 y 8 g de H2O). Por ejemplo, para calcular los gramos de H2SO4 que hay en 8100 g de disolución, multiplicaríamos por el factor de conversión 92 g H2SO4/100 g disolución:
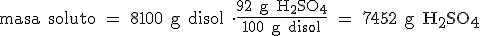
Importante
El tanto por ciento en masa indica los gramos de soluto que hay en 100 gramos de disolución.
La densidad de una disolución indica la masa (g, kg) de disolución que hay en un volumen (mL, L) de disolución.
Ejemplo o ejercicio resuelto
El ácido sulfúrico reacciona con el magnesio formando sulfato de magnesio e hidrógeno:
Mg + H2SO4 → MgSO4 + H2
Halla la masa de magnesio que reacciona con 200 ml de una disolución de H2SO4 de 1,8 g/ml de densidad y 92% en masa de riqueza.
Datos. Masas atómicas: H = 1u ; S = 32u ; O = 16u ; Mg = 24,3.
Escribimos la magnitud que nos piden, el signo "igual" y el dato de partida:
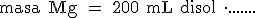
Quitamos "mL disol" y ponemos "g disol" teniendo en cuenta que en 1 mililitro de disolución hay 1,8 gramos de disolución:
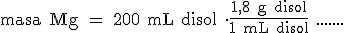

Quitamos "g H2SO4" y ponemos "mol H2SO4", teniendo en cuenta que 1 mol de H2SO4 son 98 g:

Pasamos de "mol de H2SO4" a "mol de Mg", y por último, de "mol de Mg" a "g de Mg":
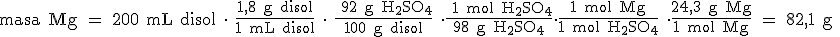
AV - Reflexión
Dada la reacción:
Si añadimos a una muestra de carbonado de calcio, 100 mL de ácido clorhídrico del 36% de riqueza en masa y densidad 1,18 g/mL, calcula:
a) La masa de carbonato de calcio que se obtiene.
b) El volumen de dióxido de carbono recogido en condiciones normales.
Masas atómicas: H = 1 u; C = 12 u; O = 16 u; Cl = 35,5 u; Ca = 40 u.