2.3 Reactivo limitante y reactivo en exceso
Curiosidad
 |
| Imagen de Bill Abbott en flickr. CC |
Imagina una fábrica de coches de juguete y que el último paso de la fabricación de los mismos sea colocar las cuatro ruedas a la carrocería. Para que no sobren ni ruedas ni carrocerías, la proporción entre ellas tiene que ser de 4 a 1. Por ejemplo, si se fabrican al día 2000 coches, se necesitarán 8000 ruedas y 2000 carrocerías.
Pero, ¿qué ocurre si un día determinado sólo hay 2000 carrocerías y 7600 ruedas? Que no se podrían fabricar 2000 coches porque faltarían ruedas o, lo que es lo mismo, sobrarían carrocerías. Las carrocerías serían los componentes en exceso y las ruedas los componentes limitantes, porque determinan el número de coches que se puede fabricar.
Si dividimos 7600 ruedas entre 4, vemos que sólo se podrían fabricar 1900 coches ese día y que sobrarían 100 carrocerías.
Lo mismo ocurre en las reacciones químicas. Si las cantidades de los reactivos no están en la proporción estequiométrica, alguno de ellos no podrá reaccionar totalmente. Diremos que es el reactivo en exceso. Al reactivo que se consume totalmente lo llamaremos reactivo limitante, y tendremos que partir de la cantidad de este para resolver los problemas de estequiometría.
En los problemas que hemos resuelto hasta ahora, partíamos de una cantidad inicial de una de las sustancias que intervienen en la reacción. Pero hay veces que en el enunciado de un problema nos dan la cantidad que tenemos inicialmente de dos o más sustancias. En estos casos puede ocurrir que:
- Las cantidades estén en la proporción adecuada, es decir, en proporción estequiométrica. Las sustancias iniciales reaccionan totalmente para dar lugar a los productos. Para realizar nuestros cálculos podemos partir de cualquiera de los datos.
- Las cantidades no estén en proporción estequiométrica. Si partimos de dos sustancias, sólo una de ellas, que llamamos reactivo limitante, reacciona totalmente. Tendremos que partir de la cantidad de esta sustancia para resolver el problema.
Como ya hemos visto, cuando reaccionan dos o más sustancias lo hacen en unas proporciones definidas. Por ejemplo, cuando el oxígeno (O2) reacciona con el nitrógeno (N2) para originar monóxido de nitrógeno (NO), por cada molécula o cada mol de O2 que reaccione lo hará una molécula o un mol de N2 y se formarán 2 moléculas o 2 moles de monóxido de nitrógeno.
| N2 | + O2 |
→ | 2 NO |
| 1 molécula | 1 molécula | 2 moléculas | |
| 1 mol | 1 mol | 2 mol | |
| 28 g | 36 g | 64 g |
Luego si tenemos 2 moléculas de nitrógeno y 2 moléculas de oxígeno se formaran 4 moléculas de monóxido de nitrógeno. Siempre que tengamos las mismas moléculas de N2 que de O2 diremos que están en proporción estequiométrica, es decir, en la proporción en la que se produce la reacción.
Pero, ¿que ocurrirá si hacemos que reaccionen 6 moléculas de N2 con 2 moléculas de O2?
Las 2 moléculas de O2 reaccionarán con 2 moléculas de N2 para formar 4 moléculas de NO, y quedarán 4 moléculas de N2 sin reaccionar. El nitrógeno no reacciona totalmente porque hay más de la cuenta, es el reactivo en exceso. El oxígeno reacciona totalmente y su cantidad determina la cantidad de NO que se va a obtener. Decimos que el oxígeno es el reactivo limitante.
Para hacer nuestros cálculos tendremos que partir de la cantidad de oxígeno, que es la que se consume por completo: a partir de 2 moléculas de O2 se forman 4 moléculas de NO. Si por el contrario partimos de la cantidad de nitrógeno, nuestros resultados serían incorrectos: a partir de 6 moléculas de N2 no se pueden formar 12 moléculas de NO, porque no hay suficiente oxígeno.
Importante
Llamamos reactivo limitante a la sustancia que se consume totalmente durante la reacción química.
AV - Pregunta Verdadero-Falso
Indica si las siguientes afirmaciones, relacionadas con la reacción de formación del agua, son verdaderas o falsas:
Retroalimentación
Falso
Los 5 moles de hidrógeno reaccionarán con 2,5 moles de oxígeno y quedará un exceso de 2,5 moles de oxígeno.Retroalimentación
Verdadero
2 mol de H2 (4 g) reaccionan con 1 mol de O2 (32 g) para dar 2 mol de H2O (36 g). Con 16 g de O2 (0,5 mol) reaccionaran 2 g de H2 (1mol) para dar 18 g de H2O (1 mol)Retroalimentación
Falso
En volumenes iguales de gases diferentes medidos a la misma P y T, hay el mismo número de moléculas. Luego, en 20 L de hidrógeno hay el doble de moléculas que en 10 litros de oxígeno; por tanto, están en proporción estequiométrica. Como se tienen que formar las mismas moléculas de agua que las que reaccionan de hidrógeno, el volumen que ocuparán estas es 20 litros.¿Cómo sabemos cuál es el reactivo limitante?
Sólo tendremos que determinar que reactivo es el limitante, en los problemas en los que se parte de cantidades de dos o más sustancias. Para ello, tienes que hallar la proporción entre las cantidades de las distintas sustancias y compararla con la proporción estequiométrica entre ellas. Lo entenderás mejor con ejemplos:
La proporción estequiométrica entre las moléculas o los moles de las sustancias que intervienen en la reacción viene indicada por los coeficientes de la reacción; ya sabes, los números que colocamos delante de las fórmulas para ajustar la ecuación.
En la reacción anterior la proporción estequiométrica entre moléculas y moles de N2 y O2 es 1/1. Además, como 1 mol de N2 son 2x14 g = 28 g y 1 mol de O2 son 2x 16 g = 32 g, la relación estequiométrica entre sus masas es 28 g/36 g = 0,78:
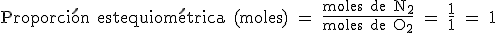 |
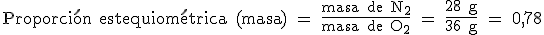 |
Imagínate que en el enunciado de un problema te dicen que reaccionan 3 moles de N2 con 2 moles de O2. Como la proporción entre estas cantidades no es 1, no están en proporción estequiométrica; o lo que es lo mismo, una de las sustancias está en exceso.
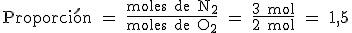 |
Como 1,5 es mayor que 1, esto significa que la cantidad de nitrógeno, que está en el numerador, es mayor a la que se necesita para que las dos sustancias reaccionen totalmente (si aumenta el numerador, aumenta el valor de la fracción). Por lo tanto, el reactivo que se consume totalmente, el reactivo limitante y del que tendríamos que partir para realizar cálculos estequiométricos, es el oxígeno.
¿Y si tenemos 2 moles de N2 y 3 moles de O2? En esta caso, la proporción anterior es menor a uno. Esto significa que hay más oxígeno del necesario (si aumenta el denominador disminuye el valor de la fracción). En este caso, el oxígeno sería el reactivo en exceso y el nitrógeno el reactivo limitante.
Si en vez de trabajar con la proporción entre moles, trabajamos con la proporción en masa, el reactivo limitante se determina de la misma manera.
Importante
Si la proporción entre las cantidades de dos sustancias es mayor a la proporción estequiométrica, está en exceso la sustancia que va en el numerador. El reactivo limitante será la sustancia que va en el denominador de la proporción.
Si la proporción entre las cantidades de dos sustancias es menor a la proporción estequiométrica, el reactivo limitante será la sustancia que va en el numerador de la proporción.
Ejemplo o ejercicio resuelto
El cinc reacciona con el ácido clorhídrico según la ecuación:
Zn + HCl → ZnCl2 + H2
Si mezclamos 20 g de cinc con una disolución que contiene 1,2 moles de HCl, calcula:
a) El reactivo que está en exceso y la cantidad del mismo que no reacciona.
b) El volumen de H2 que se obtiene medido en condiciones normales.
Dato: Masa atómica Zn = 65,4 u
La ecuación química está sin ajustar. Para que el número de átomos de cada elemento sea el mismo a la derecha y a la izquierda de la flecha, tenemos que poner un "2" delante del HCl:
Zn + 2 HCl → ZnCl2 + H2
a) La relación estequiométrica entre los moles de HCl y de Zn es 2/1. Vamos a calcular los moles de Zn que tenemos para compararlos con los moles de HCl:

|
La relación entre los moles iniciales de HCl y Zn es:
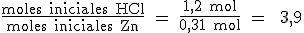
|
La relación inicial (3,9) es mayor que la estequiométrica (2). Esto indica que hay exceso del reactivo que se encuentra en el numerador de dicha relación, es decir, de HCl. Como cada mol de Zn reacciona con 2 moles de HCl, los 0,31 mol de Zn reaccionarán con 2x0,31 mol = 0,62 mol de HCl y quedarán en exceso 0,58 moles de HCl (1,2 - 0,62 = 0,58).
b) Tendremos que partir, por tanto, de 0,31 mol de Zn o de 0,62 mol de HCl, que son las cantidades que reaccionan. Vamos a partir, por ejemplo, de los 0,31 moles de Zn. Tenemos que pasar de moles de Zn a moles de H2 fijándonos en la ecuación química ajustada, y luego, de moles de H2 a litros, teniendo en cuenta que 1 mol de cualquier gas en condiciones normales ocupa 22,4L:
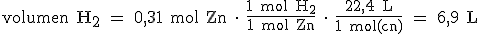
|
AV - Reflexión
El carbonato de calcio puede reaccionar con cloro para dar óxido de dicloro cloruro de calcio y dióxido de carbono:
CaCO3 (s) + Cl2 (g) → Cl2O (g) + CaCl2 (s) + CO2 (g) (sin ajustar)
Si reaccionan 200 g de carbonato de calcio con 178 g de cloro, halla:
a) El reactivo limitante.
b) La masa de CaCl2 que se obtiene.
c) El volumen obtenido de dióxido de carbono medido en condiciones normales.
Datos. Masas atómicas: C = 12 u; O = 16 u; Cl = 35’5 u; Ca = 40 u.