7. La neutralización
Conocimiento previo
El trabajo más frecuente en todos los laboratorios químicos consiste en la realización de análisis cualitativos (¿qué sustancias hay en una muestra?) y cuantitativos (¿cuánto hay de cada una de ellas?). El análisis cuantitativo determina las cantidades de sustancias químicas expresadas como pureza de muestras o concentración de disoluciones. Por ejemplo, determinar el porcentaje de un determinado metal contenido en un mineral, el porcentaje de ácido acético en un vinagre, la concentración de cloro en el agua, etc.
 |
| Imagen de elaboración propia |
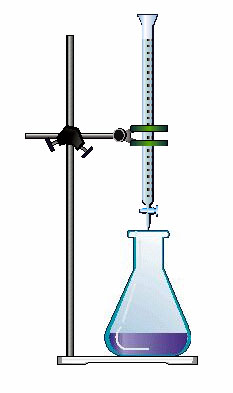
Los métodos volumétricos son los más sencillos, y, además, el material necesario es barato. Se usa un soporte con una pinza de bureta, una bureta y un erlenmeyer. Con un trabajo adecuado por parte del experimentador se consiguen errores menores del 1%.
Las reacciones químicas en una valoración volumétrica deben ser completas, rápidas y se debe determinar con facilidad el punto final de la reacción. Las reacciones de neutralización ácido-base cumplen estas tres características.
En las volumetrías se dispone de dos disoluciones, de forma que un volumen determinado de la disolución de concentración desconocida (25 ml generalmente) se coloca en el erlenmeyer, y se llena la bureta con la disolución valorante, de concentración conocida.
Se va añadiendo disolución desde la bureta hasta que se observa el final de la reacción, por medio del cambio de color del indicador. En ese momento, se lee el volumen añadido de disolución, según la escala de la bureta.
Vas a ver una explicación teórica, basada en la teoría de Bronsted-Lowry, del proceso que tiene lugar cuando un ácido reacciona con una base, en la reacción llamada de neutralización.
Reacción de neutralización entre un ácido fuerte y una base fuerte
Toma como ejemplo de ácido fuerte el ácido clorhídrico, HCl (aq). Ya sabes que en esta disolución acuosa la ionización es completa [los iones presentes son el ion H3O+(aq), y el ion cloruro, Cl-(aq)]
HCl (aq) → Cl- + H3O+
A esta disolución se le añade una disolución acuosa de hidróxido de sodio, NaOH (aq) [los iones presentes en la misma son el ion sodio, Na+(aq), y el ion hidróxido, OH-(aq)]
NaOH (aq) → Na+ + OH-
La reacción que ocurre la puedes escribir de la siguiente forma:
Cl-(aq) + H3O+(aq) + OH-(aq) + Na+(aq) → 2 H2O + Na+(aq) + Cl-(aq)
que se puede simplificar como: HCl +NaOH → H2O + NaCl
ya que H3O+ + OH- → 2H2O ó H+ + OH- → H2O
Esta reacción es completa ya que su constante de equilibrio es muy grande (es 1014 a 25 ºC).
Si se van añadiendo pequeñas cantidades de base fuerte a la disolución de ácido fuerte, la reacción de neutralización es un proceso que tiene lugar mientras existen iones H3O+(aq). Este proceso deja de producirse cuando los iones H3O+(aq) han reaccionado completamente. Ello ocurre cuando las cantidades del ácido y de la base están en la relación estequiométrica, que es un mol de cada sustancia en el ejemplo. En ese instante, la situación química que resulta corresponde a la de una disolución acuosa de la sal formada; en este caso, de cloruro de sodio [Na+(aq) y Cl-(aq)], como puedes ver en el siguiente vídeo.
Actividad
La reacción de neutralización entre un ácido y una base da como productos SAL + AGUA
|
Los únicos protones (o iones hidroxilo) presentes en la disolución son los procedentes del agua, por tanto [H3O+]=[OH-].
La reacción de neutralización ácido fuerte-base fuerte alcanza pH = 7
Objetivos
Realización de una volumetría ácido-base
| Vídeo de Kosasisihkandarsjah alojado en Youtube |
- Se toma una cierta cantidad de la disolución problema a valorar, y se sitúa en un matraz erlenmeyer, junto con unas gotas de indicador. La elección del indicador se hace teniendo en cuenta el ácido y la base que reaccionan, como verás más adelante.
- Se prepara una disolución del agente valorante, de concentración conocida, y con ella se llena la bureta. El agente valorante será un ácido si el problema a valorar es una base; análogamente, el agente valorante será una base si el problema a valorar es un ácido.
- Se va añadiendo poco a poco la disolución de la bureta, agitando el erlenmeyer para lograr una mezcla rápida de ambos reactivos. Esta adición se detiene en el momento del viraje del indicador a un color persistente (punto final de la valoración). Este cambio de color indica que las cantidades puestas a reaccionar han sido las estequiométricas.