2.2 Constantes y grado de disociación
De una manera cuantitativa, la fuerza de un ácido (o de una base) puede expresarse mediante el valor de la constante del equilibrio de reacción de dicho ácido (o base) con agua (sustancia de referencia).
Así, para el caso general de un ácido HA el proceso es: HA + H2O ![]() A-(aq) + H3O+(aq).
A-(aq) + H3O+(aq).
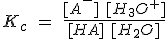
En disoluciones acuosas diluidas, que son las que se manejan corrientemente, la concentración del agua permanece prácticamente constante (igual a la del agua pura, 55,5 mol/L), por lo que puede incluirse en la constante de equilibrio, con lo que resulta:

Esta constante Ka se llama constante de disociación o de ionización (también constante de acidez), y mide cuantitativamente la fuerza del ácido HA respecto del agua. Cuanto mayor sea el valor de Ka, más fuerte será el ácido (y más débil su base conjugada A-).
De forma análoga se procede para la fuerza de una base B:
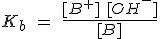
siendo Kb la constante de disociación o de ionización de una base (constante de basicidad), que mide la fuerza de una base.
Grado de disociación
En términos de equilibrio químico, un ácido o una base es fuerte si su equilibrio de disociación está totalmente desplazado a la derecha, en el sentido de la ionización.
Se suele utilizar el grado de disociación, que es el porcentaje de sustancia disociada. Si x es la concentración disociada y c0 la concentración inicial de sustancia, el grado de disociación es:
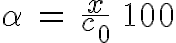
Los ácidos fuertes como HCl, HNO3 o H2SO4, están disociados prácticamente en un 100% en disoluciones acuosas no demasiado concentradas.
Un ácido o base es tanto más débil cuanto menor es el grado de ionización. En los ácidos o base muy débiles, el grado de ionización puede ser menor del 1%.
En la simulación puedes ver que el HCl está totalmente ionizado, de acuerdo con el proceso
HCl + H2O → Cl-(aq) + H3O+(aq)
mientras que HA está ionizado en una proporción pequeña: en la simulación solamente se ve a dos moléculas que se ionizan, transfiriendo protones según el proceso
HA + H2O ↔ A-(aq) + H3O+(aq)
| Grabación de simulación Proyecto TIGER, Uso educativo |
Grabación de simulación Proyecto TIGER, Uso educativo |
Actividad
Ácidos y bases fuertes y débiles
Son fuertes si el grado de disociación es del 100%, y débiles si es menor, siendo frecuente que sea del orden del 1%.
AV - Pregunta de Elección Múltiple
Actividad
El parámetro que permite comparar la fuerza de dos ácidos o de dos bases es la constante de su equilibrio de disociación (Ka ó Kb).
Más adelante aprenderás a utilizar las Ka y Kb para determinar las concentraciones de todas las especies químicas presentes en un equilibrio ácido-base y calcular el valor del pH de las disoluciones.
 |
| Imagen de ISFTIC, CC |
Predicción de reacciones ácido-base
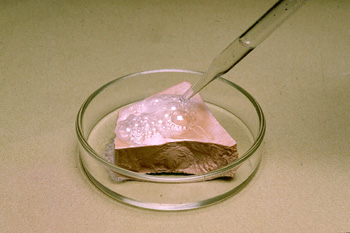
Los valores de las constantes de acidez permiten predecir en qué sentido estará desplazado un equilibrio de transferencia de protones. En la imagen puedes ver el ataque del HCl al CaCO3, en el que se disuelve el trozo de mármol y se forman burbujas de CO2.
¿Por qué se produce la reacción? (ten en cuenta que el HCl es un ácido fuerte, y que el H2CO3 es un ácido débil, por tanto, el CO32- es una base fuerte, con apreciable tendencia a captar los protones que cede el HCl, con lo que las reacciones producidas son:
2 HCl(aq) + CaCO3(s) ![]() CaCl2(aq) + H2CO3(aq)
CaCl2(aq) + H2CO3(aq)
H2CO3(aq) ![]() H2O(l) + CO2(g)
H2O(l) + CO2(g)
Así que ya sabes: ¡no se te ocurra intentar limpiar con salfumán (disolución de HCl concentrado, que hay que manejar con muchísimo cuidado) una encimera de mármol, cuyo principal componente es CaCO3!