4. Sustancias moleculares
Pre-conocimiento
 |
| Imagen de Michel Mañas, CC |
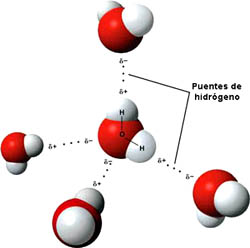
Como ya sabes, las sustancias moleculares, están formadas por moléculas, en las que varios átomos se unen entre sí por enlaces covalentes. Las moléculas se unen entre sí por fuerzas intermoleculares que, como ya has visto, pueden ser:
- Enlace por puentes de hidrógeno.
- Fuerzas de Van der Waals, que pueden ser de dos tipos:
- Interaciones dipolares.
- Fuerzas dispersivas.
 |
| Imagen de Jurii, Creative commons |
ESTADOS DE AGREGACIÓN.
Al ser las fuerzas intermoleculares relativamente pequeñas las sustancias moleculares son, en general, gaseosas a temperatura ambiente y sólo en aquellos casos en que las fuerzas intermoleculares son más intensas se encuentran en estado líquido o gaseoso.
En cualquier caso, los punto de fusión y ebullición son relativamente bajos y pueden explicarse teniendo en cuenta las fuerzas intermoleculares.
- Enlace por puentes de hidrógeno: aparecen cuando la molécula tiene átomos de hidrógeno unidos mediante enlace covalente a átomos de flúor, oxígeno o nitrógeno. Las sustancias que presentan enlaces por puentes de hidrógeno tienen unos puntos de fusión y ebullición especialmente elevados.
- Fuerzas de Van der Waals: Estas débiles fuerzas de interacción entre las moléculas también logran elevar los puntos de fusión y ebullición de las sustancias, pueden ser de dos tipos:
- Interacciónes dipolares: que aumentan al aumentar la polaridad de la molécula.
- Fuerzas dispersivas: que aumentan con la masa molecular de la sustancia.
Las fuerzas dispersivas se dan siempre, y si además las moléculas son polares, habrá también interacciones dipolares.
Por tanto, podemos decir en sentido general que las sustancias moleculares tienen bajos puntos de fusión y ebullición, por lo que se encuentran en estado gaseoso, pero a medida que las fuerzas intermoleculares son importantes, se encontrarán en estado líquido o gaseoso.
AV - Reflexión
Te dicen que los puntos de ebullición de dos hidrocarburos son -89 ºC y -42 ºC. Sabes que se trata de etano (CH3-CH3) y propano (CH3-CH2-CH3), pero no sabes qué valor corresponde a cada uno. Haz una asignación razonada de puntos de ebullición.
AV - Pregunta de Elección Múltiple
AV - Pregunta Verdadero-Falso
Retroalimentación
Falso
Hay que romper puentes de hidrógeno y fuerzas dispersivas, que son fuerzas intermoleculares, pero no hay que romper la molécula de agua.Retroalimentación
Falso
El amoniaco (NH3) es una molécula polar, por lo que presenta interacciones dipolares.Retroalimentación
Verdadero
Como son dos moléculas apolares y la de cloro tiene menor masa, las fuerzas dispersivas son menores entre moléculas de cloro. Si el cloro fuese sólido, las interacciones serían mayores, y no es ése el caso.DUREZA Y FRAGILIDAD.
Como las fuerzas de interacción entre las moléculas, son débiles, las sustancias moléculas, cuando son sólidas son blandas (es fácil arrancar unas cuantas moléculas unidas mediante fuerzas intermoleculares). No son frágiles, son moldeables, pues desplazar una molécula es muy fácil, habría que vencer sólo las fuerzas intermoleculares, que en una nueva posición, podrían volver a formarse.
SOLUBILIDAD.
Aplicando el principio: "Semejante disuelve a semejante, las sustancias moleculares polares, serán solubles en disolventes polares, como el agua. Por el contrario las sustancias apolares no son solubles en disolventes polares y sí lo serán en disolventes apolares.
En las siguientes animaciones puedes observar cómo interaccionan con el agua (disolvente polar) con una sustancia no polar, a la izquierda, y otra polar, a la derecha.
- Sustancia no polar: si la molécula es apolar, no tiene interacción alguna con el agua, por lo que las moléculas se ordenan por su densidad, resultando dos fases no miscibles, donde el líquido de mayor densidad se sitúa más abajo y el de menor densidad en la parte superior.
- Sustancia polar: cuando la sustancia a disolver es polar, las moléculas de agua interaccionan con las moléculas de la sustancia a disolver, arrancándolas, quedando las moléculas de agua unidas a las de la sustancia. Puede observarse que como la molécula, aunque polar, es neutra, la disolución resultante no conduce la corriente eléctrica, como sí ocurre en los compuestos iónicos.
| Sustancia apolar |
Sustancia polar |
| Simulaciones del Proyecto Tiger, Uso educativo | |
CONDUCTIVIDAD ELÉCTRICA.
Como no tienen carga eléctrica neta, no conducen la corriente eléctrica en ningún estado.
Sin embargo, algunas sustancias moleculares producen iones cuando se disuelven en agua, y en ese caso la disolución formada sí conduce la electricidad: es el caso del HCl, que en agua forma iones Cl- y H3O+ . Estas sustancias reciben el nombre de electrolitos.
HCl + H2O → Cl- + H3O+