2. Sustancias metálicas
Pre-conocimiento

|
| Imagen con licencia CC |
Recuerda que un enlace metálico es un enlace químico que mantiene unidos a los átomos metálicos. Los átomos metálicos, al tener muy poca electronegatividad y ser muy electropositivos, pierden los electrones de la capa de valencia, que pasan a formar una nube de electrones y se sitúan formando una red muy compacta inmersa en esa nube de electrones. Al perder todos los electrones de la capa de valencia, la anterior pasa a ser la capa de valencia y queda con una configuración electrónica estable como la del gas noble.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas.
 |
| Imagen de Scott Edhart, Dominio público |
CONDUCTIVIDAD ELÉCTRICA.
La propiedad más característica de los metales, es la conducción de la corriente eléctrica: por agitación térmica los electrones se mueven desordenadamente en todas direcciones y a lo largo de toda la red, de acuerdo con el modelo de la nube electrónica o del gas electrónico.
 |
| Simulación del Proyecto Newton, Creative commons |
Como los electrones tiene muy poca masa (más de cien mil veces menor que la de un ion de cobre), se mueven con facilidad entre los iones. Si se someten dos puntos de un metal a una diferencia de potencial, los electrones se mueven con facilidad hacia el polo positivo, de mayor potencial. Este flujo de partículas cargadas en movimiento -electrones en este caso- es precisamente la corriente eléctrica.
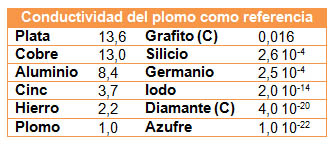
En la tabla siguiente tienes los datos de conductividad eléctrica de varias sustancias (metales y no metales), tomando como referencia unidad, la conductividad del plomo. Fíjate en que la variación es muy grande, desde 13,6 de la plata, el mejor conductor, hasta 10-22 del azufre, que es un aislante. Observa los valores del grafito, que tiene una conductividad apreciable y por eso se utiliza para fabricar electrodos, y el silicio, que es un semiconductor, fundamental en la industria electrónica.
 |
| Imagen de Pearle, CC |
ESTADOS DE AGREGACIÓN.
Todas las sustancias metálicas son sólidas a temperatura ambiente, con excepción del mercurio. Este hecho indica que las fuerzas de cohesión de los átomos metálicos son importantes.
El punto de fusión es muy variable, desde el entorno de 50-100 ºC de los alcalinos (28 ºC el cesio), pasando por el estaño, usado en soldadura electrónica, hasta los 3410 ºC del wolframio, utilizado en filamentos de bombillas incandescentes.
DUREZA Y FRAGILIDAD.
Su dureza es media o baja, dependiendo de la intensidad del enlace: en
general, las más duras tienen puntos de fusión más altos.
|
|
| Animación de Mariano Gaite Cuesta |
Si se trata de átomos pequeños que se ordenan en redes muy compactas, la densidad es muy elevada, como ocurre en el
osmio, iridio y platino, superiores a 22 g/cm3 , aunque en algunos casos como litio, sodio o potasio, flotan en el
agua (densidad menor de 1 g/cm3).
No son frágiles como sucede con las sustancias iónicas, sino que
resultan maleables y dúctiles, pudiendo cambiar su forma al golpearlos.
En algunos casos, incluso se pueden doblar con la mano (hilos de cobre,
chapas finas de aluminio, etc). Esto se debe a que al deformar un poco
la red se obtiene una estructura espacial de los átomos similar a la
inicial (por el contrario, al deformar una red iónica se enfrentaban iones del mismo
signo, que al repelerse producían su fractura, como ya has visto los sólidos iónicos sí son frágiles).
SOLUBILIDAD.
No se disuelven en ningún líquido. En agua los metales no se disuelven, pero algunos de ellos reaccionan con ella formando óxidos o hidróxidos. Es decir, reaccionan químicamente con el liquido (agua) y se disuelven, pero al evaporar el líquido no se recupera la sustancia inicial, ya que se han formado otras sustancias. Por ejemplo, el sodio reacciona con violencia con el agua, formándose hidróxido de sodio en disolución y desprendiéndose gas hidrógeno. Al evaporar la disolución, se recupera hidróxido de sodio y no el metal.
OTRAS PROPIEDADES.
Su calor específico es muy bajo; es decir, se calientan con facilidad al comunicarles energía en forma de calor. Como además los metales conducen muy bien el calor, no sólo aumentan apreciablemente su temperatura, sino que lo hacen muy deprisa. Por esta razón se utilizan en cocina para fabricar cacerolas, ollas y sartenes.