1. Sustancias iónicas
Pre-conocimiento
 |
| imagen de Dr T, Creative commons |
En las sustancias iónicas los iones se unen mediante intensas fuerzas electrostáticas, que se manifiestan en todas las direcciones del espacio. Los iones de un signo están rodeados por iones de signo contrario, y al revés, estableciéndose un equilibrio entre las fuerzas atractivas que se producen entre iones de signo contrario con las repulsivas que hay entre iones del mismo signo.
La magnitud que determina la intensidad de estas fuerzas es la energía de red: es la energía desprendida al formarse un mol de sustancia iónica a partir delos iones en estado gaseoso. La energía de red es tanto mayor cuanto mayores son las cargas de los iones y menores son los tamaños de los iones.
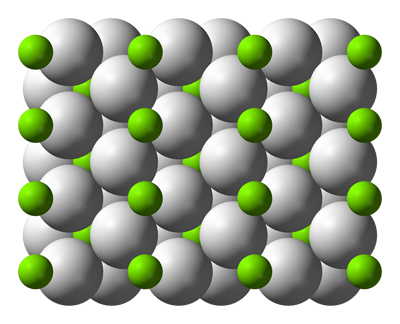 |
| Imagen de Benjah-bmm27, Dominio público |
ESTADOS DE AGREGACIÓN.
Los iones no están en reposo sino que, debido a la agitación térmica producida por la temperatura a la que se encuentra la sustancia, oscilan dentro de un espacio reducido. Al calentar la sustancia, esta agitación térmica va siendo mayor. Si esta agitación térmica es lo suficientemente grande, entonces se rompe la red cristalina y pasa sucesivamente a estado líquido y a estado gaseoso.
La energía de red determina los puntos de fusión y ebullición de los compuestos iónicos, de manera que cuanto mayor es la energía de red, mayores son los puntos de fusión y ebullición. La energía de red, como ya sabes, depende de las cargas de los iones y del tamaño que tengan. La energía de red es tanto mayor cuanto mayores son las cargas de los iones y cuanto menor sea su tamaño.
Debido a la intensidad de esas fuerzas, los puntos de fusión y los de ebullición, son medios o altos, ya que para que los iones se separen por agitación térmica hay que alcanzar temperaturas elevadas. De esta forma, todas las sustancias iónicas son sólidas a temperatura ambiente.
AV - Pregunta de Elección Múltiple
Solution
DUREZA Y FRAGILIDAD.
También la energía de red, es la responsable de que sean sustancias duras, ya que no es fácil separar los iones: al rayar una sustancia, se separan algunas de las partículas que la forman (iones), por lo que se deben vencer las fuerzas que las mantienen unidas en el sólido.
  |
| Imagen de Antimoni, Creative commons |
Cuando se golpea un cristal iónico se produce un desplazamiento de las capas iónicas. Observa en la imagen cómo inicialmente los iones de un signo rodean a los de otro, si por efecto del golpe quedan enfrentados iones del mismo signo, las fuerzas repulsivas aumentan notablemente, y la estructura se abre por una zona de corte prácticamente perfecto: el cristal puede llegar a hacerse añicos si el golpe es lo bastante fuerte. En consecuencia, son sustancias frágiles.
AV - Reflexión
 |
| Simulación de Elaboración propia |
SOLUBILIDAD.
Precisamente el hecho de que el agua sea una molécula polar le proporciona una de sus características más conocidas: es un disolvente extraordinario, tanto que es el medio en el que se desarrolla la vida en el planeta.
Observa la animación, en la que se simula el proceso de disolución de un cristal iónico en agua. Los iones pasan del sólido a la disolución, de manera que las interacciones ion-ion se rompen, estableciéndose interacciones entre los iones y las moléculas de agua. Cuanto más débiles sean las interacciones entre iones (menor sea la energía de red), más fácilmente se disolverá la sustancia iónica en agua.
Las sustancias iónicas, en general, solamente son solubles en disolventes polares, del tipo del agua, pero su solubilidad es muy variable, desde grande a prácticamente nula, dependiendo de las características de la sustancia iónica, pues cuanto mayor sea la energía de red, menor será la solubilidad.
AV - Reflexión
CONDUCTIVIDAD ELÉCTRICA.
En estado sólido, los iones se encuentran fijos en una red cristalina, sin ninguna movilidad, por eso los sólidos iónicos no conducen la corriente eléctrica, que no es más que el desplazamiento de las cargas eléctricas.
Pero cuando los sólidos iónicos funden o se disuelven entonces los iones adquieren cierta movilidad por lo que sí conducen la corriente eléctrica.
Una característica particular de las sustancias iónicas es que no conducen la corriente eléctrica en estado sólido, pero sí lo hacen al fundir o disolverse en agua.